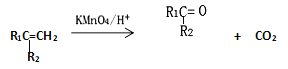
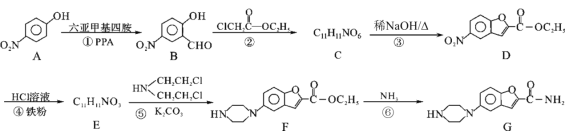
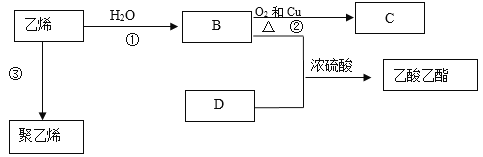
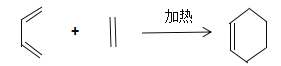题目内容
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=_______________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________________________________。
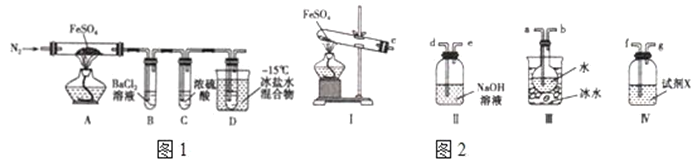
(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/mol/L | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol/L | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①0~5min,用NO2的浓度变化表示的反应速率为_________________。
②以下表述能说明该反应己达到平衡状态的是________。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡_______(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _________________。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式______________________。
【答案】ΔH2 - 3ΔH1 2NH3 - 6e- + 6OH- = N2 + 6H2O 0.06mol/(Lmin) AC 增大 0.11或![]() 12NO + 7ClO2- + 12OH- = 8NO3- + 4NO2- + 7Cl- + 6H2O
12NO + 7ClO2- + 12OH- = 8NO3- + 4NO2- + 7Cl- + 6H2O
【解析】
(1)根据盖斯定律解题;氨气燃料电池,氮元素化合价升高失电子,氨气为负极,发生氧化反应;
(2)①根据v=△c/△t计算。
②变量不在发生变化证明反应达到了平衡;
③对平衡影响相当于加压;
④列出三行式,在计算k
(3)亚氯酸钠具有氧化性,则溶液脱硝过程中发生反应生成硝酸根离子、亚硝酸根离子、氯离子和水,根据表格可知生成的离子的物质的量之比,写出离子方程式。
(1)根据盖斯定律②-①×③计算可得;氨气气燃料电池通燃料的为负极,发生氧化反应,结合电解质溶液书写负极电极反应式为2NH3 - 6e- + 6OH- = N2 + 6H2O;
答案:ΔH2 - 3ΔH1 2NH3 - 6e- + 6OH- = N2 + 6H2O
(2)①v=△c/△t=(2.0mol/L-1.7mol/L)/5min=0.06mol/(Lmin);
答案:0.06mol/(Lmin)
②A.反应平衡前,NO2的浓度在变化,颜色在变化,当化学达到平衡,颜色就不再变化了,故A正确;
B.由于反应物均为气体,且反应前后质量守恒,且容器为恒容的气体,故气体密度一直不变,无法判断反应是否平衡,故B错误;
C.由于此反应的反应物和生成物均为气体,故气体总质量一直不变,而此反应在平衡之前气体的物质的量在减小,故平衡之前的平均相对分子质量在增大,当不变时化学反应达到平衡,故C正确;
答案:AC
③20min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,相当于增大压强,平衡向正反应方向移动,所以的转化率变大;
答案:增大
④列出三行式:
4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g)
N2(g)+4CO2(g)
c(初) 2.0 2.0 0 0
△c 1.0 0.5 0.25 1.0
C(平衡)1.0 1.5 0.25 1.0
K=![]() =
=![]() 或0.11
或0.11
答案:0.11或![]()
(3)亚氯酸钠具有氧化性,则溶液脱硝过程中发生反应生成硝酸根离子、亚硝酸根离子、氯离子和水,根据表格可知生成的离子的物质的量之比,故总反应的离子方程式为12NO + 7ClO2- + 12OH- = 8NO3- + 4NO2- + 7Cl- + 6H2O
答案:12NO + 7ClO2- + 12OH- = 8NO3- + 4NO2- + 7Cl- + 6H2O

 阅读快车系列答案
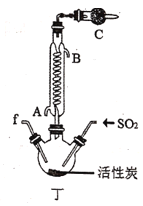
阅读快车系列答案【题目】实验室用干燥而纯净的氯气和二氧化硫合成硫酰氯(SO2Cl2),原理为SO2+Cl2![]() SO2Cl2,装置如图所示(夹持仪器已省略):
SO2Cl2,装置如图所示(夹持仪器已省略):
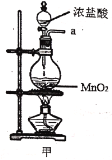
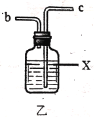
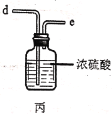
已知有关物质的部分性质如表:
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 不易分解 |
请回答下列问题:
(1)写出甲中制取Cl2的化学方程式___。
(2)利用图中甲、乙、丙装置制取干燥纯净的Cl2,并在丁装置合成硫酰氯,要完成实验目的,按气流从左到右,各接口正确的连接顺序是___。
A.abcdef B.abcedf C.acbdef D.acbedf
乙中试剂X是___。
(3)丁中冷凝管进水口为___(填“A”或“B”)。装置C的作用是___。
(4)硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是___。