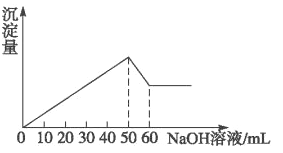
题目内容
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:高温分解FeSO4,利用如图1所示的实验装置进行实验.
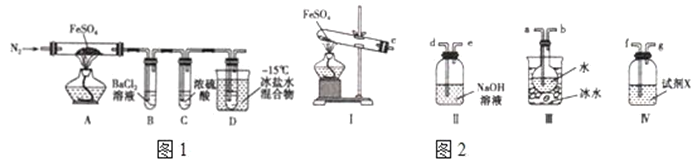
已知:①SO2熔点为﹣72℃,沸点为﹣10℃;
②SO3熔点为﹣16.8℃,沸点为44.8℃。
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是__________________________。
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为______,同时有两种无色气体生成,写出该反应的化学方程式_________________________________。
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是___,将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是__________________________。
(4)有人认为该实验装置存在一定的缺陷,再增加一个装置即可弥补该缺陷,请指出添加的仪器位置及药品________________________________________________________________。
【答案】排除装置中的空气 红棕色 2FeSO4![]() Fe2O3+SO2↑+SO3↑ Fe2O3+6H+=2Fe3++3H2O 2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ 在最后加一个盛碱石灰的干燥管或NaOH溶液;
Fe2O3+SO2↑+SO3↑ Fe2O3+6H+=2Fe3++3H2O 2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ 在最后加一个盛碱石灰的干燥管或NaOH溶液;
【解析】
(1)通入氮气的目的是排除装置中的空气;
(2)根据题意同时有两种无色气体生成,B中有白色沉淀,则两种气体可能为二氧化硫和三氧化硫,根据化合价的改变,则还有Fe2O3;
(3)Fe2O3与盐酸反应生成氯化铁和水;将反应后所得溶液(氯化铁)滴入D试管中,溶液铁离子被还原为变为浅绿色的亚铁离子,二氧化硫被氧化为硫酸根离子,据此写出离子方程式;
(4)考虑D装置连接空气,该反应需要排除空气中二氧化碳和水与D中二氧化硫反应。
(1)通入氮气的目的是排除装置中的空气;
答案是:排除装置中的空气;
(2)B中有白色沉淀,可能为硫酸钡或者亚硫酸钡,有两种无色气体生成,则应为二氧化硫和三氧化硫,硫元素化合价降低,则铁元素化合价升高为三氧化二铁,红棕色;该反应的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑ ;
Fe2O3+SO2↑+SO3↑ ;
答案是:红棕色;2FeSO4![]() Fe2O3+SO2↑+SO3↑ ;
Fe2O3+SO2↑+SO3↑ ;
(3) Fe2O3与盐酸反应的离子方程式为: Fe2O3+6H+=2Fe3++3H2O ;将反应后所得溶液滴入D试管中,溶液铁离子被还原为变为浅绿色的亚铁离子,二氧化硫被氧化为硫酸根离子,该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;
答案是: 2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ ;
(4)最后的D装置连接了空气,需排除空气的影响,在D的后面加一个吸收二氧化碳和水的装置,以防与D中的二氧化硫反应,装置内试剂可以是碱石灰或NaOH溶液;
答案是:在最后加一个盛碱石灰的干燥管或NaOH溶液。

【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=_______________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________________________________。
(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/mol/L | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol/L | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①0~5min,用NO2的浓度变化表示的反应速率为_________________。
②以下表述能说明该反应己达到平衡状态的是________。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡_______(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _________________。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式______________________。