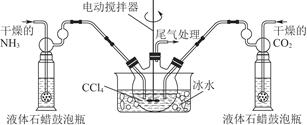
题目内容
用下列实验或实验装置进行的实验中,能达到相应实验目的的是( )
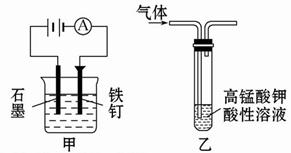

| A.装置甲:防止铁钉生锈 |
| B.测定同温同浓度的NaCl和NaF溶液的pH,确定F、Cl两元素的非金属性的强弱 |
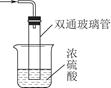
| C.装置乙:除去乙烷中混有的乙烯 |
| D.用Ca(OH)2溶液来鉴别Na2CO3溶液和NaHCO3溶液 |
A
本题考查了化学实验的设计。元素非金属性的强弱可以通过元素的最高价氧化物对应水化物的酸性来比较,而通过比较无氧酸盐溶液的pH,无法确定元素的非金属性强弱,故B错;乙烯被酸性高锰酸钾溶液氧化,生成的CO2仍会混在乙烷中,故C错;D中Na2CO3溶液和NaHCO3溶液和Ca(OH)2反应都有CaCO3沉淀生成,故D错。

练习册系列答案
相关题目
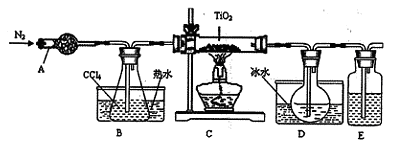
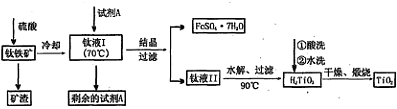

 无沉淀
无沉淀 白色沉淀
白色沉淀 气体
气体 褪色
褪色 棕黄色溶液
棕黄色溶液 蓝色溶液
蓝色溶液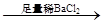 白色沉淀
白色沉淀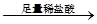 沉淀溶解
沉淀溶解