题目内容
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g)??NH2COONH4(s) ΔH<0。
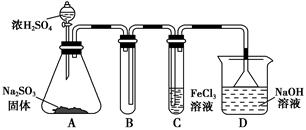
(1)如图所示装置制取氨气,你所选择的试剂是________________________。

(2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
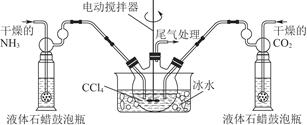
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。
液体石蜡鼓泡瓶的作用是________________________________________________________________________。
②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________
(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。
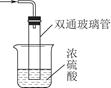
双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[Mr(NH2COONH4)=78,Mr(NH4HCO3)=79,Mr(CaCO3)=100]
2NH3(g)+CO2(g)??NH2COONH4(s) ΔH<0。
(1)如图所示装置制取氨气,你所选择的试剂是________________________。

(2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。
液体石蜡鼓泡瓶的作用是________________________________________________________________________。
②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________
(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。

双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[Mr(NH2COONH4)=78,Mr(NH4HCO3)=79,Mr(CaCO3)=100]
(1)浓氨水与氢氧化钠固体(CaO、碱石灰)等合理答案
(2)①降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解) 通过观察气泡,调节NH3与CO2的通入比例
②过滤 c
③防止倒吸 吸收多余的氨气 防止空气中的水蒸气进入反应器使氨基甲酸铵水解
(3)80%
(2)①降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解) 通过观察气泡,调节NH3与CO2的通入比例
②过滤 c
③防止倒吸 吸收多余的氨气 防止空气中的水蒸气进入反应器使氨基甲酸铵水解
(3)80%
(1)CaO与浓氨水中的水反应放热使氨气易于逸出。(2)该反应为放热反应,低温利于反应正向进行,且产物易分解,故采取冰水浴冷却、低温烘干等。(3)n(CaCO3)=n(C元素)=1.500 g÷100 g· mol-1=0.015 mol,n(NH2COONH4)=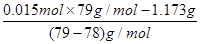 =0.012 mol。氨基甲酸铵的物质的量分数为
=0.012 mol。氨基甲酸铵的物质的量分数为 ×100%=80%。
×100%=80%。
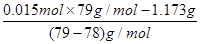 =0.012 mol。氨基甲酸铵的物质的量分数为
=0.012 mol。氨基甲酸铵的物质的量分数为 ×100%=80%。
×100%=80%。
练习册系列答案
相关题目

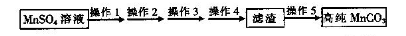
 已除干净; 操作4:___________________;
已除干净; 操作4:___________________;