题目内容
14. 原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.(1)X、Y、Z、W四种元素形成的简单离子,按离子半径由大到小的排列顺序是(用离子符号表示)S2->O2->F->H+.
(2)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的浓溶液能与Cu反应,其反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
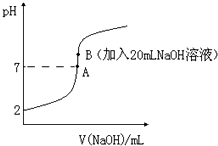
(3)25℃下,将一定量Z或W的氢化物溶于水得0.125mol•L-1 酸M溶液,向20.00ml酸M滴加0.125mol•L-1的NaOH溶液时,溶液的pH变化如图所示.已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力.
电离度(α)=$\frac{n(已电离的弱电解质)}{n(全部的弱电解质)}$×100%
请回答下列问题:
①在B点若生成的为正盐,则酸M的化学式为:HF.
②在此温度下,酸M的电离度(α)=8%.(用百分数表示)
③已知在此温度下:
Ⅰ1mol 酸M完全电离时吸收b kJ热量
ⅡH+(aq)+OH-(aq)=H2O(1)△H=-a kJ•mol-1;
则该过程中,酸M与NaOH中和反应的热化学方程式为:HF(aq)+NaOH(aq)?NaF(aq)+H2O(aq)△H=-(a-b)kJ•mol-1;在忽略酸M中阴离子水解时产生的热效应情况下,反应达到B点时,滴加过程中所释放的热量为0.0025a-0.0023bkJ(用只含a、b的式子表示).
分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Y、W位于同主族,设Y的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Z的原子序数为x+1,由四种元素的原子序数之和为34,则1+(x+1)+x+(x+8)=34,解得x=8,即Y为O元素,Z为F元素,W为S元素.
(1)离子核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小;
(2)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的浓溶液能与Cu反应,应为H2SO4,浓硫酸与铜在加热条件下发生氧化还原反应;
(3)①在B点若生成的为正盐,此时NaOH的物质的量与酸的物质的量相等;
②由图象可知0.125mol•L-1 酸HF溶液的pH=2,则c(H+)=0.01mol/L,以此计算;
③则Ⅰ+Ⅱ可得HF(aq)+NaOH(aq)?NaF(aq)+H2O(aq)△H=-(a-b)kJ•mol-1,结合热化学方程式以及HF的电离度计算.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Y、W位于同主族,设Y的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Z的原子序数为x+1,由四种元素的原子序数之和为34,则1+(x+1)+x+(x+8)=34,解得x=8,即Y为O元素,Z为F元素,W为S元素.
(1)离子核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小,应为S2->O2->F->H+,故答案为:S2->O2->F->H+;
(2)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的浓溶液能与Cu反应,应为H2SO4,浓硫酸与铜在加热条件下发生氧化还原反应,反应的化学方程式为Cu+2 H2SO4 (浓)$\frac{\underline{\;加热\;}}{\;}$ CuSO4+SO2↑+2H2O,
故答案为:Cu+2 H2SO4 (浓)$\frac{\underline{\;加热\;}}{\;}$ CuSO4+SO2↑+2H2O;
(3)①F、S的氢化物对应的溶液都为弱酸,在B点若生成的为正盐,此时NaOH的物质的量与酸的物质的量相等,则应生成NaF,对应的酸为HF,故答案为:HF;
②由图象可知0.125mol•L-1 酸HF溶液的pH=2,则c(H+)=0.01mol/L,则电离度(α)=$\frac{0.01}{0.125}×100%$=8%,
故答案为:8%;
③已知在此温度下:
Ⅰ1mol 酸M完全电离时吸收b kJ热量,即HF(aq)?H+(aq)+F-(aq)△H=+bkJ/mol,
ⅡH+(aq)+OH-(aq)=H2O(1)△H=-a kJ•mol-1;
则Ⅰ+Ⅱ可得HF(aq)+NaOH(aq)?NaF(aq)+H2O(aq)△H=-(a-b)kJ•mol-1,
0.125mol•L-1 酸HF溶液的电离度为8%,n(HF)=0.125mol•L-1×0.02L=0.0025mol,则未电离的HF的物质的量为0.0025mol×92%,电离吸收的热量为0.0025mol×92%×bkJ/mol=0.0023bkJ,进一步发生H+(aq)+OH-(aq)=H2O(1),放出的热量为0.0025akJ,
所以滴加过程中所释放的热量为(0.0025a-0.0023b)kJ
故答案为:HF(aq)+NaOH(aq)?NaF(aq)+H2O(aq)△H=-(a-b)kJ•mol-1;0.0025a-0.0023b.
点评 本题考查位置结构性质的应用、无机物推断等,明确Y、Z、W的位置及原子序数的关系来推断元素是关键,需要学生熟练掌握元素化合物性质,易错点为(3),注意把握反应热的计算,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 | |
| B. | 工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 | |
| C. | 为了有效的发展清洁能源,采用电解水的方法大量制备H2 | |
| D. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 | |
| E. | 利用化学反应原理,设计和制造新的药物 |
| A. | 测得这种液体的pH值等于7 | |
| B. | 在1.01×105Pa的压强下测得其沸点为373K | |
| C. | 电解这种液体,在阴极得到的气体体积为阳极气体体积的两倍 | |
| D. | 测得该液体不导电 |
| A. | 往FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | Fe(OH)2溶于稀HNO3中:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | Fe2O3溶与足量的氢溴酸:Fe2O3+6H++2Br-═2Fe2++Br2+3H2O | |
| D. | HCl滴入NaAlO2溶液中:AlO2-+H++H2O=Al(OH)3↓ |
| A. | 5.6 g铁与足量氯气完全反应转移的电子数为0.2NA | |
| B. | 100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子均为0.2NA | |
| C. | 标准状况下,22.4 L CO2与22.4 L H2O所含原子数均为3 NA | |
| D. | 体积分别为1.0L pH=2的盐酸与硫酸溶液中氢离子数均为0.01NA |

 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.