题目内容
19.下列离子方程式中正确的是( )| A. | 往FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | Fe(OH)2溶于稀HNO3中:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | Fe2O3溶与足量的氢溴酸:Fe2O3+6H++2Br-═2Fe2++Br2+3H2O | |
| D. | HCl滴入NaAlO2溶液中:AlO2-+H++H2O=Al(OH)3↓ |
分析 A.离子方程式两边不满足电荷守恒;
B.稀硝酸具有强氧化性,能够氧化亚铁离子;
C.铁离子氧化性小于溴单质,则二者不会发生氧化还原反应;
D.偏铝酸钠能够与适量氢离子反应生成氢氧化铝沉淀.
解答 解:A.往FeCl2溶液中通入Cl2,反应生成氯化铁,正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.Fe(OH)2溶液中加入HNO3溶液,二者发生氧化还原反应,正确的离子反应为:3Fe(OH)2+NO3-+10H+═8H2O+3Fe3++NO↑,故B错误;
C.Fe2O3溶与足量的氢溴酸,反应生成溴化铁和水,正确的离子方程式为:Fe2O3+6H++═2Fe3++3H2O,故C错误;
D.HCl滴入NaAlO2溶液中,若氢离子适量,反应生成氢氧化铝沉淀,反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
相关题目
9.请选择适当的试剂.用以除去括号内的杂质,并写出相关的化学方程式
A.KSCN溶液 B.Fe C.氧水 D.稀盐酸 E.NaOH溶液 F.氨水
A.KSCN溶液 B.Fe C.氧水 D.稀盐酸 E.NaOH溶液 F.氨水
| 物质 | 加入试剂 | 有关化学方程式 |
| FeCl2(FeCl3)(溶液) | Fe | 2FeCl3+Fe=3FeCl2 |
| MgO(Al2O3) | NaOH溶液 | Al2O3+2NaOH═2NaAlO2+H2O |
7.下列有关物质的性质、制取或应用等的说法中正确的是( )
| A. | 用10%的盐酸蒸发浓缩获得30%的盐酸 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 二氧化硫具有漂白性,与氯水混合使用效果更好 | |
| D. | 可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
4.下列实验能达到目的是( )
| A. |  称量25g氢氧化钠 称量25g氢氧化钠 | B. |  H2O2溶液制备O2 | C. | 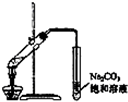 乙酸乙酯的制备 乙酸乙酯的制备 | D. | 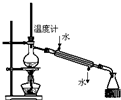 石油蒸馏 |
11.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺流程如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Mg2+):
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
(1)实验室用18.4mol•L-1的浓硫酸配制250mL 4.8mol•L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需量筒、250mL容量瓶、胶头滴管;
(2)滤渣II是Fe(OH)3、Al(OH)3,过滤II步骤能否省略,为什么?
不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2-.
(3)写出滤液中加入H2O2发生反应的两种方程式2Cr3++3H2O2+H2O=Cr2O72-+8H;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L-1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
②计算该产品中Na2CrO4的质量分数为66.67%.
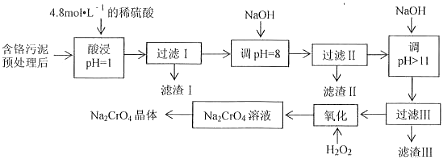
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
| 阳 | Fe | Mg | Al | Cr |
| 开始沉淀时的H | 1.9 | 9.0 | -- | -- |
| 沉淀完全时的H | 3. | 11.1 | 8 | 9 (>9溶解) |
(2)滤渣II是Fe(OH)3、Al(OH)3,过滤II步骤能否省略,为什么?
不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2-.
(3)写出滤液中加入H2O2发生反应的两种方程式2Cr3++3H2O2+H2O=Cr2O72-+8H;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L-1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
②计算该产品中Na2CrO4的质量分数为66.67%.

 原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.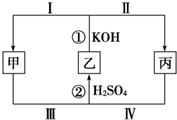 化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.
化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.