题目内容
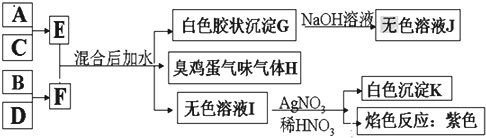
2.有一化合物A,其水溶液为浅绿色,可发生如下的转化关系.
其中B、D、E为无色气体,W、K为常见的金属单质,C为难溶于水的红褐色固体.在混合液中加入BaCl2可生成不溶于稀HNO3的白色沉淀,H和W反应可放出大量的热.
(1)写出下列物质的化学式:A(NH4)2Fe(SO4)2 FNO
(2)写出下列反应的化学方程式J与NaOH溶液反应:Al2O3+2NaOH=2NaAlO2+H2O,F→G:4NO+3O2+2H2O=4HNO3,
K与过量G溶液反应的离子方程式:Fe+4H++NO3-=Fe3++NO+2H2O;
(3)电解混合液的阳极电极反应式为4OH--4e-=O2↑+2H2O;
(4)原混合液的体积为VmL,pH为a,密度为ρ1g/mL,电解一段时间后,收集到标况下D的体积为bL,若此时溶液的密度为ρ2g/mL,则此溶液的c(OH-)为$\frac{5.6{ρ}_{2}V1{0}^{a-14}}{5.6{ρ}_{1}V-9b}$mol/L(用字母表示).
分析 K和W为常见的金属单质,W和H反应可放出大量的热,该反应为铝热反应,则M为Al,L为Fe;C为难溶于水的红褐色固体,则C为Fe(OH)3,H为Fe2O3,然后结合转化关系图可知,A为Fe(OH)2,X的水溶液为浅绿色,混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,沉淀为硫酸钡,B、D、E均为无色气体,B应为氨气,则X为(NH4)2Fe(SO4)2;电解硫酸钠溶液生成E为H2,D为O2,氨气与氧气反应生成F为NO,NO、氧气、水反应生成的G为硝酸,然后结合物质的性质及化学用语来解答.
解答 解:K和W为常见的金属单质,W和H反应可放出大量的热,该反应为铝热反应,则M为Al,L为Fe;C为难溶于水的红褐色固体,则C为Fe(OH)3,H为Fe2O3,然后结合转化关系图可知,A为Fe(OH)2,X的水溶液为浅绿色,混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,沉淀为硫酸钡,B、D、E均为无色气体,B应为氨气,则X为(NH4)2Fe(SO4)2;电解硫酸钠溶液生成E为H2,D为O2,氨气与氧气反应生成F为NO,NO、氧气、水反应生成的G为硝酸,
(1)根据分析可知,A为:(NH4)2Fe(SO4)2,F为NO,故答案为:(NH4)2Fe(SO4)2;NO;
(2)J为氧化铝,氧化铝与氢氧化钠溶液反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O;F为NO,一氧化氮与氧气、水反应生成硝酸,反应的化学方程式为:4NO+3O2+2H2O=4HNO3;K为Fe,铁与过量硝酸反应的离子方程式为:Fe+4H++NO3-=Fe3++NO+2H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;4NO+3O2+2H2O=4HNO3;Fe+4H++NO3-=Fe3++NO+2H2O;
(3)电解混合液时阳极氢氧根失去电子生成氧气,其电极反应式为:4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
(4)电极氢氧化钠、硫酸钠的混合液,相当于电解水,标况下bL氧气的物质的量为:$\frac{bL}{22.4L/mol}$=$\frac{b}{22.4}$mol,电解过程中消耗水的质量为:$\frac{b}{22.4}$mol×2×18g/mol=$\frac{9b}{5.6}$g,
原混合液的体积为VmL,pH为a,则溶液中氢氧根离子的物质的量为:10a-14mol/L×V×10-3L=V×10a-17mol,
电解后溶液质量为:ρ1Vg-$\frac{9b}{5.6}$g,电解后溶液的体积为:$\frac{{ρ}_{1}Vg-\frac{9b}{5.6}g}{{ρ}_{2}g/mL}$=$\frac{5.6{ρ}_{1}V-9b}{5.6{ρ}_{2}}$mL,
所以电解后溶液中氢氧根离子浓度为:c(OH-)=$\frac{V×1{0}^{a-17}mol}{\frac{5.6{ρ}_{1}V-9b}{5.6{ρ}_{2}}×1{0}^{-3}L}$=$\frac{5.6{ρ}_{2}V1{0}^{a-14}}{5.6{ρ}_{1}V-9b}$mol/L,
故答案为:$\frac{5.6{ρ}_{2}V1{0}^{a-14}}{5.6{ρ}_{1}V-9b}$mol/L.
点评 本题考查无机物的推断,为高频考点,题目难度中等,把握铝热反应及电解原理为解答的关键,注意K、W、H为推断物质的突破口,侧重金属及其化合物之间转化的考查,(4)的计算量较大,需要明确反应原理及反应实质.

 阅读快车系列答案
阅读快车系列答案| A. | 都属于氧化还原反应 | B. | 生成的气体均为氧化产物 | ||
| C. | 反应物水均作氧化剂 | D. | 反应均放热 |
①提出假设:假设1:Fe2+还原性强于I-;假设2:I-还原性强于Fe2+
②设计实验方案,写出实验步骤、预期现象和结论.其他限选试剂:3mol•L-1 H2SO4、0.01mol•L-1KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液.
| 实 实验步骤 | 预期现象与结论 |
| 步步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加再滴加几滴氯水. | 溶 溶液变成黄色,推测有Fe3+或I2生成. |
| 步骤2:向试管中继续滴加几滴20%KSCN溶液或向试管中继续滴加几滴淀粉溶液 | 溶液不变红,说明I-的还原性强于Fe2+或溶液变蓝,说明I-的还原性强于Fe2+ |
| A. | 用10%的盐酸蒸发浓缩获得30%的盐酸 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 二氧化硫具有漂白性,与氯水混合使用效果更好 | |
| D. | 可利用丁达尔效应来区别淀粉溶液和氯化钠溶液 |
| A. | 熔沸点:H2O>HF>HCl | B. | 原子半径:Mg>Na>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 热稳定性:H2O>HF>H2S |
 .
.
 原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族. 化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.
化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素.