题目内容
6. 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.
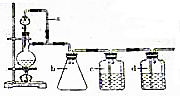
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH2CH=CH2+CO+H2$→_{△}^{催化剂}$CH3CH3CH2CHO$→_{△}^{H_{2}催化剂}$CH3CH2CH2CH2OH.原料CO的制备原理:HCOOH$→_{△}^{浓H_{2}SO_{4}}$CO↑+H2O,并设计出原料气的制备装置如图.
请填写下列空白:
(1)若用以上装置制备干燥纯净的CO装置中a和b的作用分别是保持恒压、防倒吸;c和d中盛装的试剂分别是NaOH溶液、浓硫酸.请指出上述装置存在的一处明显不足是缺少尾气处理装置.
(2)若用上述装置支取丙烯,缺少的玻璃仪器名称是温度计.因制丙烯的过程中常有副产物SO2、CO2,确认丙烯存在时需将气体先通过c、d装置,c、d中分别盛装的试剂是氢氧化钠反应、品红溶液,再通过酸性高锰酸钾溶液或溴水检验.
(3)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醛粗品,为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3(饱和)→RCH(OH)SO2Na↓;
②沸点:乙醚34℃,1-丁醇118℃.
设计出如下提纯路线:
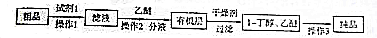
试剂1为饱和NaHSO3溶液,操作1为过滤,操作2为萃取,操作3为蒸馏.
检验纯品中是否有正丁醛的试剂是氢氧化铜悬浊液或银氨溶液.
(4)若用20mL(密度为0.8g/mL)的丙醇制正丁醛,制丙烯反应中丙醇的转化率85%,丙烯制正丁醛反应中丙烯的转化率78.5%,正丁醛的分离提纯中损失率1.5%,请计算丙醇制正丁醛的产率:85%×78.5%×(1-1.5%)(列出计算式).
分析 (1)甲酸在浓硫酸的作用下通过加热脱水生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压,CO直接排放会污染空气,最终需要进行尾气处理;
(2)用上述装置制取丙烯,需要用温度计控制温度;
检验丙烯可以用酸性KMnO4溶液或溴水,SO2也能与酸性KMnO4溶液褪色、溴水反应,应向用氢氧化钠溶液除去,再利用品红溶液检验SO2是否除尽;
(3)粗品中含有正丁醛,根据所给的信息,利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇,经过分液操作与NaHSO3溶液分离,因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开;
正丁醛含有醛基,利用氢氧化铜悬浊液或银氨溶液检验;
(4)将每一步的利用率或损失率都转化为起始原料的利用率或损失率,据此计算原料的实际利用率,产品的产率等于起始原料的实际利用率.
解答 解:(1)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;
CO直接排放会污染空气,最终需要进行尾气处理,上述装置存在的一处明显不足是:缺少尾气处理装置,
故答案为:保持恒压;防倒吸; NaOH溶液;浓硫酸;缺少尾气处理装置;
(2)用上述装置制取丙烯,需要用温度计控制温度;
检验丙烯可以用酸性KMnO4溶液或溴水,SO2也能与酸性KMnO4溶液褪色、溴水反应,应向用氢氧化钠溶液除去,再利用品红溶液检验SO2是否除尽,
故答案为:温度计;氢氧化钠溶液;品红溶液;
(3)粗品中含有正丁醛,根据所给的信息,利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇,经过分液操作与NaHSO3溶液分离,因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开;
正丁醛含有醛基,利用氢氧化铜悬浊液或银氨溶液检验,
故答案为:饱和NaHSO3溶液;过滤;萃取;蒸馏;氢氧化铜悬浊液或银氨溶液;
(4)将每一步的利用率或损失率都转化为起始原料的利用率或损失率,则原料的实际利用率为85%×78.5%×(1-1.5%),产品的产率等于起始原料的实际利用率,即产品产率为85%×78.5%×(1-1.5%),
故答案为:85%×78.5%×(1-1.5%).
点评 本题考查有机物合成方案、物质的检验、物质的分离提纯、对装置的分析评价、有损失率的多步反应计算等,题目综合性较大,明确原理是解题关键,是对学生综合能力的考查,难度中等.

| A. | ①②③④ | B. | ②③①④ | C. | ④①③② | D. | ③④①② |
| A. | 熔沸点:H2O>HF>HCl | B. | 原子半径:Mg>Na>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 热稳定性:H2O>HF>H2S |
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
| 阳 | Fe | Mg | Al | Cr |
| 开始沉淀时的H | 1.9 | 9.0 | -- | -- |
| 沉淀完全时的H | 3. | 11.1 | 8 | 9 (>9溶解) |
(2)滤渣II是Fe(OH)3、Al(OH)3,过滤II步骤能否省略,为什么?
不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2-.
(3)写出滤液中加入H2O2发生反应的两种方程式2Cr3++3H2O2+H2O=Cr2O72-+8H;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L-1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
②计算该产品中Na2CrO4的质量分数为66.67%.


| A. | 按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-3-乙基庚烷 | |
| B. | 有机物(图2)的一种芳香族同分异构体能发生银镜反应 | |
| C. | 高分子化合物(图3),其单体为对苯二甲酸和乙醇 | |
| D. | 前期在西非国家爆发的埃博拉疫情极具蔓延之势,已知该病毒对化学药品敏感.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜粉溶于氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| C. | 氯气与冷氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向氯化铝溶液中加入过量氨水:4OH-+Al3+═AlO2-+2H2O |
 原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为34,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Y、W位于同主族.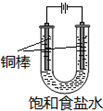 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取. [CuCl3]2-(无色溶液)逆向移动,生成CuCl.
[CuCl3]2-(无色溶液)逆向移动,生成CuCl.