题目内容
【题目】下表为元素周期表的粗表,①~⑧分别表示元素周期表中对应位置的元素
① | |||||||||||||||||
⑧ | ③ | ⑤ | |||||||||||||||
② | ④ | ||||||||||||||||
⑥ | |||||||||||||||||
⑦ | |||||||||||||||||
(1)用电子式表示①与②形成化合物A 的过程:________
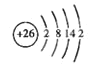
(2)已知⑥原子的最外层有2个电子,请画出⑥原子的结构示意图:______________
(3)含有④元素的某种18 电子的离子与H+及OH-均可发生反应,请写出该离子的电子式______
(4)元素③④⑤的简单气态氢化物的稳定性由强到弱的顺序是_________(用化学式表示),其沸点由高到低的顺序是_______ (用化学式表示)
(5)已知⑦的稳定化合态为+2 价,且⑦与③可按3:4 形成某化合物,该化合物具有较强氧化性, 可以与浓盐酸反应并释放出一种黄绿色的气体, 请写出该化学方程式:_________________
(6)①与③,①与④能形成18个电子的化合物,此两种化合物在溶液中发生反应的化学方程式为_________。
(7)⑧的一种氧化物为无色气体,在空气中能迅速变成红棕色。在一定条件下,2L的该无色气体与0.5 L 的氧气混合,该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则所生成的一种含氧酸盐的化学式是_________。
(8)两种均含①与②③④四种元素的化合物相互反应放出气体的离子方程式为_________。
【答案】![]()
![]() HF>H2O>H2S H2O>HF>H2S Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O H2S+H2O2=S+H2O NaNO2 HSO3-+H+= H2O+SO2↑
HF>H2O>H2S H2O>HF>H2S Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O H2S+H2O2=S+H2O NaNO2 HSO3-+H+= H2O+SO2↑
【解析】
根据题干图表分析可知,①元素位于元素周期表的第一周期第ⅠA族,为H元素,②元素位于元素周期表的第三周期第ⅠA族,为Na元素,③元素位于元素周期表的第二周期第ⅥA族,为O元素,④元素位于元素周期表的第三周期第ⅥA族,为S元素,⑤元素位于元素周期表的第二周期第ⅦA族,为F元素,⑥元素位于元素周期表第四周期第Ⅷ族,为26号元素Fe,⑦元素位于元素周期表的第六周期第ⅣA族,为Pb元素,⑧元素位于元素周期表的第二周期第ⅤA族,为N元素,据此分析解答问题。
(1)由上述分析可知,①为H元素,②为Na元素,两者形成的化合物A为离子化合物NaH,用电子式表示其形成过程为![]() ,故答案为:
,故答案为:![]() ;
;
(2)⑥为Fe元素,核外共有26个电子,原子的最外层有2个电子,则其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)含有S元素的某种18电子的离子与H+及OH-均可发生反应,该离子为HS-,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)非金属性越强,简单气态氢化物的稳定性越强,由于非金属性:F>O>S,则气态氢化物的稳定性:HF>H2O>H2S,因为H2O和HF分子中含有氢键,故沸点均大于H2S,且一个H2O分子中可形成两个氢键,故沸点:H2O>HF,则H2O>HF>H2S,故答案为:HF>H2O>H2S;H2O>HF>H2S;
(5)由题干已知,Pb的稳定化合态为+2价,且Pb与O可按3:4形成某化合物Pb3O4,该化合物具有较强氧化性,可以与浓盐酸反应并释放出一种黄绿色的气体Cl2,根据氧化还原反应规律可得出其化学反应方程式为:Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O,故答案为:Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O;
(6)H与O形成的18电子的化合物为H2O2,H与S形成的18电子的化合物为H2S,H2S在溶液中可被H2O2氧化生成S单质,反应方程式为H2S+H2O2=S+H2O,故答案为:H2S+H2O2=S+H2O;
(7)⑧为N元素,N的某种氧化物是一种无色气体,该气体在空气中迅速变成红棕色,则该气体为NO,2L的NO与0.5LO2相混合,该混合气体被足量NaOH溶液全吸收后没有气体残留,生成C的含氧酸盐只有一种,设含氧酸盐中N的化合价为x,根据得失电子守恒,2L×[x-(+2)]=0.5L×4,解得x=+3,所得含氧酸盐的化学式为NaNO2,故答案为:NaNO2;
(8)两种均含H、Na、O、S四种元素的化合物可相互反应放出气体,可以是硫酸氢钠与亚硫酸氢钠反应生成硫酸钠、二氧化硫和水,离子反应方程式为HSO3-+H+= H2O+SO2↑,故答案为:HSO3-+H+= H2O+SO2↑。

【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向NaHS溶液中滴入酚酞 | 溶液变红色 | HS-水解程度大于电离程度 |
B | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I |
A. AB. BC. CD. D