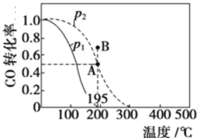
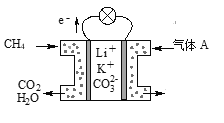
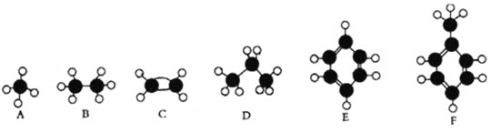
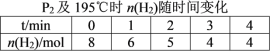题目内容
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。

下列说法正确的是
A. N2(g)+O2(g)=2NO(g) △H=-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) △H=+90![]()
C. 断开1mol NO(g)中化学键需要吸收632kJ能量
D. 形成1 mol NO(g)中化学键可释放90kJ能量
【答案】C
【解析】
由示意图可知,该反应反应物总能量小于生成物总能量,为吸热反应,△H>0。
A项、该反应为吸热反应,N2(g)+O2(g)=2NO(g) △H=+180kJ/mol,故A错误;
B项、正反应为吸热反应,逆反应应该为放热反应,则NO(g)=1/2N2(g)+1/2O2(g) △H=-90![]() ,故B错误;
,故B错误;
C项、反应热等于反应物键能之和减去生成物的键能之和,△H=[(946kJ/mol+498kJ/mol))- 2×E(N—O)]= +180kJ/mol,E(N—O)=632 kJ/mol,则断开1mol NO(g)中化学键需要吸收632kJ能量,故C正确;
D项、反应热等于反应物键能之和减去生成物的键能之和,△H=[(946kJ/mol+498kJ/mol))- 2×E(N—O)]= +180kJ/mol,E(N—O)=632 kJ/mol,则形成1 mol NO(g)中化学键可释放632kJ能量,故D错误。

【题目】下表为元素周期表的粗表,①~⑧分别表示元素周期表中对应位置的元素
① | |||||||||||||||||
⑧ | ③ | ⑤ | |||||||||||||||
② | ④ | ||||||||||||||||
⑥ | |||||||||||||||||
⑦ | |||||||||||||||||
(1)用电子式表示①与②形成化合物A 的过程:________
(2)已知⑥原子的最外层有2个电子,请画出⑥原子的结构示意图:______________
(3)含有④元素的某种18 电子的离子与H+及OH-均可发生反应,请写出该离子的电子式______
(4)元素③④⑤的简单气态氢化物的稳定性由强到弱的顺序是_________(用化学式表示),其沸点由高到低的顺序是_______ (用化学式表示)
(5)已知⑦的稳定化合态为+2 价,且⑦与③可按3:4 形成某化合物,该化合物具有较强氧化性, 可以与浓盐酸反应并释放出一种黄绿色的气体, 请写出该化学方程式:_________________
(6)①与③,①与④能形成18个电子的化合物,此两种化合物在溶液中发生反应的化学方程式为_________。
(7)⑧的一种氧化物为无色气体,在空气中能迅速变成红棕色。在一定条件下,2L的该无色气体与0.5 L 的氧气混合,该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则所生成的一种含氧酸盐的化学式是_________。
(8)两种均含①与②③④四种元素的化合物相互反应放出气体的离子方程式为_________。