题目内容
【题目】近年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
实验目的:通过实验证明煤中含有碳元素和硫元素。
查阅资料:
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:___。
( )SO2+( )MnO4-+( )=( )+( )Mn2++( )
根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
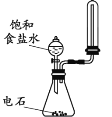
实验探究:甲同学:甲同学进行了如图所示A、B两步实验:

“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是___:
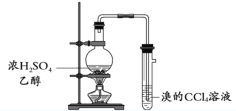
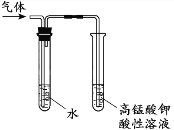
实验探究:丙同学:丙同学进行了如图所示实验(部分装置在图中略去):

(3)图C装置的作用是___。
(4)证明煤中含有碳元素和硫元素的现象是:___。
(5)装置C中的高锰酸钾溶液也可以替换为___。
A.足量I2的淀粉溶液
B.足量饱和NaHCO3溶液
C.足量Na2SO3溶液
D.足量溴水
【答案】(5)SO2+(2)MnO4-+(2)H2O=(5)SO42-+(2)Mn2++(4)H+ SO2也能使澄清石灰水变浑浊,不能证明煤中含有碳元素 除去SO2并检验其是否除尽 B中褪色,C中不褪色,D中变浑浊 AD
【解析】
(1)SO2被MnO4-氧化为SO42-,根据得失电子守恒、电荷守恒配平离子方程式;
(2)SO2和氢氧化钙反应生成亚硫酸钙沉淀和水;
(3)在装置A中使煤充分燃烧,通过B稀酸性高锰酸钾溶液来检验SO2;通过C浓酸性高锰酸钾溶液来除去SO2,以确保完全除尽,再通过D澄清石灰水来检验CO2气体。
(1)SO2被MnO4-氧化为SO42-,S元素化合价由+4升高为+6、Mn元素化合价由+7降低为+2,根据得失电子守恒、电荷守恒配平离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(2)SO2和氢氧化钙反应生成亚硫酸钙沉淀和水,B中澄清石灰水变浑浊,不能证明煤中含有碳元素;
(3)SO2被MnO4-氧化为SO42-,装C用浓酸性高锰酸钾溶液来除去SO2,以确保完全除尽,防止干扰CO2的检验;
(4)SO2能使高锰酸钾褪色,证明煤中含有硫元素的现象是B中溶液褪色;CO2能使澄清石灰水变浑浊,证明含有碳元素的现象是C中不褪色,D中变浑浊;
(5)高锰酸钾溶液有强氧化性,可以把SO2氧化为硫酸。若用其它物质来代替,只要物质有强氧化性,可以与SO2发生氧化还原反应即可。
A.I2+SO2+2H2O=H2SO4+2HI,SO2能被吸收,I2与CO2不能发生反应,故选A;
B.NaHCO3+SO2= NaHSO3+CO2.虽然能除去SO2,但是能产生CO2,会影响CO2的检验,故不选B;
C.Na2SO3+SO2+2H2O=2NaHSO3,由于该溶液呈碱性,也能吸收CO2,所以会影响CO2的检验,故不选C;
D. Br2+SO2+2H2O=H2SO4+2HBr,SO2能被吸收,溴水与CO2不能发生反应,所以可以除去SO2中的CO2,故选D;
所以选AD。

【题目】下表为元素周期表的粗表,①~⑧分别表示元素周期表中对应位置的元素
① | |||||||||||||||||
⑧ | ③ | ⑤ | |||||||||||||||
② | ④ | ||||||||||||||||
⑥ | |||||||||||||||||
⑦ | |||||||||||||||||
(1)用电子式表示①与②形成化合物A 的过程:________
(2)已知⑥原子的最外层有2个电子,请画出⑥原子的结构示意图:______________
(3)含有④元素的某种18 电子的离子与H+及OH-均可发生反应,请写出该离子的电子式______
(4)元素③④⑤的简单气态氢化物的稳定性由强到弱的顺序是_________(用化学式表示),其沸点由高到低的顺序是_______ (用化学式表示)
(5)已知⑦的稳定化合态为+2 价,且⑦与③可按3:4 形成某化合物,该化合物具有较强氧化性, 可以与浓盐酸反应并释放出一种黄绿色的气体, 请写出该化学方程式:_________________
(6)①与③,①与④能形成18个电子的化合物,此两种化合物在溶液中发生反应的化学方程式为_________。
(7)⑧的一种氧化物为无色气体,在空气中能迅速变成红棕色。在一定条件下,2L的该无色气体与0.5 L 的氧气混合,该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则所生成的一种含氧酸盐的化学式是_________。
(8)两种均含①与②③④四种元素的化合物相互反应放出气体的离子方程式为_________。