题目内容
【题目】印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol/L,FeCl2 3.0 mol/L,FeCl3 1.0 mol/L,HCl 3.0 mol/L。取废腐蚀液200 mL按如下流程在实验室进行实验:
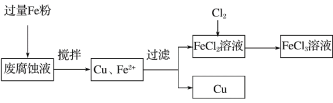
回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是________(填化学式)。
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为__________________________________。
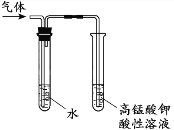
(3)如图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。

实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是__________________________________。
(4)按上述流程操作,需称取Fe粉的质量应不少于________ g(精确到0.1 g),需通入Cl2的体积不少于________ L(标况)。
【答案】HCl KClO3+6HCl(浓) ![]() 3Cl2↑+KCl+3H2O 缓慢旋动分液漏斗的活塞,调节液体滴下的速度 39.2 16.8
3Cl2↑+KCl+3H2O 缓慢旋动分液漏斗的活塞,调节液体滴下的速度 39.2 16.8
【解析】
(1)废液中含有Fe3+、Cu2+、H+能与铁粉反应;
(2) KClO3与浓HCl反应,产生KCl、Cl2、H2O,根据电子守恒及原子守恒书写方程式;
(3)缓慢旋动分液漏斗的活塞,调节液体滴下的速度,从而控制生成氯气速率;
(4)根据方程式中各个物理量之间的关系式进行计算。
(1)废液中含有Fe3+、Cu2+、H+,加入过量铁粉后,发生的离子反应为2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑,因此得到的固体Cu中含有过量的Fe粉,可以利用Fe与盐酸发生反应Fe+2HCl=FeCl2+H2↑。而Cu不能与盐酸反应,用盐酸将其中混有的杂质Fe除去;
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为KClO3+6HCl(浓) ![]() 3Cl2↑+KCl+3H2O;
3Cl2↑+KCl+3H2O;
(3)要控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是缓慢旋动分液漏斗的活塞,调节液体滴下的速度,来控制生成氯气速度;
(4)加入铁粉后,分别与氯化铜、氯化铁、盐酸反应,Fe+CuCl2=FeCl2+Cu,n(CuCl2)=1.5mol/L×0.2L=0.3mol,消耗Fe的物质的量为0.3mol;Fe+2FeCl3=3FeCl2,n(FeCl3)=1.0mol/L×0.2L=0.2mol,消耗Fe粉0.1mol;Fe+2HCl=FeCl2+H2↑,n(HCl)=3.0mol/L×0.2L=0.6mol,因此共消耗Fe粉的物质的量为0.3mol+0.1mol+0.3mol=0.7mol,质量为0.7mol×56g/mol=39.2g;通入氯气发生反应:Cl2+2FeCl2=2FeCl3,溶液中FeCl2的物质的量为n(FeCl2)= 0.3mol+0.3mol+0.3mol+3.0 mol/L×0.2L=1.5mol,根据方程式中二者关系可知需要Cl2的物质的量为n(Cl2)=![]() n(FeCl2)=0.75mol,其在标准状况下的体积为V(Cl2)= 0.75mol×22.4L/mol=16.8L。
n(FeCl2)=0.75mol,其在标准状况下的体积为V(Cl2)= 0.75mol×22.4L/mol=16.8L。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________(填标号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释表中氧化物之间熔点差异的原因__________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________pm,Mg原子之间最短距离y=__________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是__________g·cm3(列出计算表达式)。


【题目】下表为元素周期表的粗表,①~⑧分别表示元素周期表中对应位置的元素
① | |||||||||||||||||
⑧ | ③ | ⑤ | |||||||||||||||
② | ④ | ||||||||||||||||
⑥ | |||||||||||||||||
⑦ | |||||||||||||||||
(1)用电子式表示①与②形成化合物A 的过程:________
(2)已知⑥原子的最外层有2个电子,请画出⑥原子的结构示意图:______________
(3)含有④元素的某种18 电子的离子与H+及OH-均可发生反应,请写出该离子的电子式______
(4)元素③④⑤的简单气态氢化物的稳定性由强到弱的顺序是_________(用化学式表示),其沸点由高到低的顺序是_______ (用化学式表示)
(5)已知⑦的稳定化合态为+2 价,且⑦与③可按3:4 形成某化合物,该化合物具有较强氧化性, 可以与浓盐酸反应并释放出一种黄绿色的气体, 请写出该化学方程式:_________________
(6)①与③,①与④能形成18个电子的化合物,此两种化合物在溶液中发生反应的化学方程式为_________。
(7)⑧的一种氧化物为无色气体,在空气中能迅速变成红棕色。在一定条件下,2L的该无色气体与0.5 L 的氧气混合,该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则所生成的一种含氧酸盐的化学式是_________。
(8)两种均含①与②③④四种元素的化合物相互反应放出气体的离子方程式为_________。
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
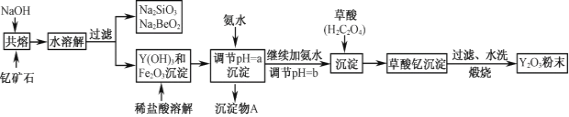
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)若改用氧化物的形式表示Y2FeBe2Si2O10组成,则化学式为__________。
(3)根据元素周期表的知识判断,常温下,氯化锶溶液pH____7(填“大于”、“等于”或“小于”);写出氯化锶的电子式:______________________。
(4)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(5)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________;检验Fe3+是否沉淀完全的操作方法是:___________________________________。
(6)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。