题目内容
【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
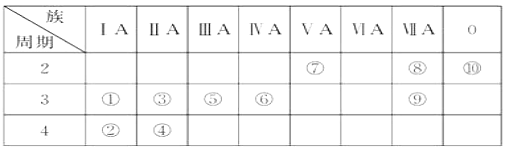
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)元素⑩名称为____在周期表中的位置_____。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是____,碱性最强的化合物的电子式是:_____。
(3)用电子式表示素④与⑥的化合物的形成过程:_____,该化合物属于____(填“共价”或“离子”)化合物。
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式_____。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是_______(用离子符号表示)。
【答案】溴 第4周期第ⅦA族 HClO4 ![]()
![]() 离子 Na2O2 S2-> Cl->K+
离子 Na2O2 S2-> Cl->K+
【解析】
根据元素在周期表中的位置判断元素的种类,利用元素周期律推断元素的性质、对应单质和化合物的性质以及结构的相似性和递变性解答该题。
根据元素在周期表中的位置判断:①为C,②为N,③为O,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br。
(1)元素⑩位于第四周期第ⅦA族,应为溴元素,故答案为:溴;第四周期第ⅦA族。
(2)元素的非金属性越强,其对应的最高价氧化物的水化物的酸性越强,由于F元素无正价,则最高价氧化物的水化物的酸性最强的化合物应是HClO4,元素的金属性越强,则对应的最高价氧化物的水合物的碱性越强,在以上元素中,金属性最强的元素为K元素,对应的KOH的碱性最强,其电子式为![]() ,故答案为:HClO4;
,故答案为:HClO4;![]() 。
。
(3)元素④为Na元素,⑥为S元素,形成的化合物为Na2S,为离子化合物,用电子式表示元素Na与S的化合物的形成过程为:![]() ,故答案为:
,故答案为:![]() ;离子。
;离子。
(4)上述元素组成的既有离子键又有非极性共价键的物质为Na2O2,故答案为:Na2O2。
(5)⑥为S元素、⑦为Cl元素、⑨为K元素,三种元素形成的离子原子核外电子排布相同,原子核外电子排布相同的离子,原子序数越大,半径越小,则有离子半径S2->Cl->K+,故答案为:S2->Cl->K+。