题目内容
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_________g。
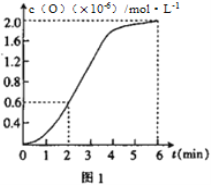
(2)已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2的平均反应速率 υ(CO2)=_________。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2的平均反应速率 υ(CO2)=_________。
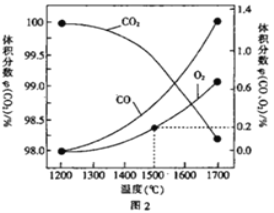
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2 所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有_________ (填字母)。
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=_________(计算结果保留1 位小数)。
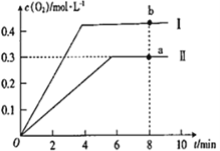
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
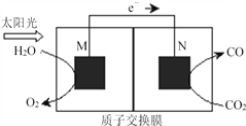
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为___________________________,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为________mol。
【答案】 0.84g 3×10-7mol·L-1·min-1 AC 3.2×10-8mol·L-1 升温 < CO2+2e-+2H+=CO+H2O 0
【解析】(1)Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,电火花不断引燃,发生反应:2CO+O2![]() 2CO2,整个过程相当于CO+Na2O2=Na2CO3,由于加入足量的Na2O2固体,则反应后的气体只能为O2;
2CO2,整个过程相当于CO+Na2O2=Na2CO3,由于加入足量的Na2O2固体,则反应后的气体只能为O2;
(2)根据化学反应速率的定义和化学反应速率之比等于对应的化学计量数之比求解
(3)①根据化学平衡状态的特点判断是否达到平衡状态;
②根据图示数据,利用化学平衡计算的“三段式”和化学平衡常数的定义进行计算;
③根据化学平衡图像特点:“先拐先平”和影响化学平衡移动的因素进行判断;
(4)根据该装置中,电子流向知,M是负极,N是正极,正极得电子发生还原反应。
(1)根据分析,Na2O2固体增加的质量相当于是CO的质量,根据碳元素守恒,所以n(CO)=0.03mol,m(CO)=0.03mol×28g/mol=0.84g,正确答案:0.84g;
(2)根据图像①2min内O的浓度增大0.6×10-6mol/L,则二氧化碳减小0.6×10-6mol/L,则v(CO2)=△c/t=0.6×10-6mol·L-1/2min=3×10-7mol·L-1·min-1,正确答案:3×10-7mol·L-1·min-1;
(3)①对应可逆反应2CO2(g)![]() 2CO(g)+O2(g),在恒温恒容条件下随着反应的进行,CO逐渐增多,当CO的量不变,即CO 的体积分数保持不变,说明反应达到平衡状态,A选项可以正确;根据质量守恒定律,反应前后都是气体,质量不变,容器的体积不变,气体密度不变,反应是否平衡不确定,所以B选项不正确;反应前后气体的质量不变,但反应前后气体的物质的量在变化,所以气体的平均摩尔质量在改变,当容器内混合气体的平均摩尔质量保持不变,说明反应达到平衡状态,C选项正确;根据反应方程式和质量守恒定律,单位时间内,消耗CO 的浓度一定等于生成CO2的浓度,D选项不能够说明反应达平衡状态,D选项错误,正确选项AC;
2CO(g)+O2(g),在恒温恒容条件下随着反应的进行,CO逐渐增多,当CO的量不变,即CO 的体积分数保持不变,说明反应达到平衡状态,A选项可以正确;根据质量守恒定律,反应前后都是气体,质量不变,容器的体积不变,气体密度不变,反应是否平衡不确定,所以B选项不正确;反应前后气体的质量不变,但反应前后气体的物质的量在变化,所以气体的平均摩尔质量在改变,当容器内混合气体的平均摩尔质量保持不变,说明反应达到平衡状态,C选项正确;根据反应方程式和质量守恒定律,单位时间内,消耗CO 的浓度一定等于生成CO2的浓度,D选项不能够说明反应达平衡状态,D选项错误,正确选项AC;
②设生成的氧气为xmol,
2CO2(g)![]() 2CO(g)+O2(g)
2CO(g)+O2(g)
起始量(mol): 1 0 0
转化量(mol): 2x 2x x
平衡量(mol): 1-2x 2x x,
平衡时,氧气的体积分数为0.2,则X/(1+X)=0.2%,则x=0.002,则c(CO2)=0.996mol/L,c(CO)=0.004mol/L,c(O2)=0.002mol/L,
则K=[C(O2)×C2(CO)]/C2(CO2)≈3.2×10-8molL-1;正确答案为:3.2×10-8molL-1;
③根据题干中图像:升高温度,CO2的体积分数减小,说明2CO2(g)![]() 2CO(g) +O2(g)平衡正向移动,正反应是一个吸热反应,b先达到平衡状态,且O2的浓度增大,说明平衡正向移动,所以改变的条件是升高温度;a点与b点相比,b点温度高,反应速率大,所以υa(CO) <υb( CO);正确答案:升高温度;<;
2CO(g) +O2(g)平衡正向移动,正反应是一个吸热反应,b先达到平衡状态,且O2的浓度增大,说明平衡正向移动,所以改变的条件是升高温度;a点与b点相比,b点温度高,反应速率大,所以υa(CO) <υb( CO);正确答案:升高温度;<;
(4)该装置中,根据电子流向知,M是负极,发生的电极反应是:2H2O-4e-=4H++O2↑,N是正极,正极得电子发生还原反应,反应式为CO2+2e-+2H+=CO+H2O,根据得失电子守恒,当转移4mol电子,M电极产生4mol氢离子,N电极消耗4mol氢离子,所以氢离子通过质子交换膜由M极到N极,M极电解质溶液中H+改变量为0mol正确答案:CO2+2e-+2H+=CO+H2O;0。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)元素⑩名称为____在周期表中的位置_____。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是____,碱性最强的化合物的电子式是:_____。
(3)用电子式表示素④与⑥的化合物的形成过程:_____,该化合物属于____(填“共价”或“离子”)化合物。
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式_____。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是_______(用离子符号表示)。