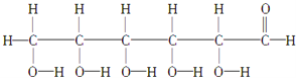
题目内容
【题目】将m g由铜与镁组成的混合物加入含n mol HNO3的稀硝酸中,两者恰好完全反应,生成V1 mL标准状况下的NO气体(假定还原产物只有NO),再向所得溶液中加入V2 mL 6 mol·L-1 NaOH溶液,溶液中金属离子恰好完全沉淀,测得生成(m+10.2)g沉淀。下列相关判定一定不正确的是( )
A. m=19.2B. n=0.8
C. V1=4.48D. V2=200
【答案】AD
【解析】
将mg由铜与镁组成的混合物加入含nmolHNO3的稀硝酸中,两者恰好完全反应,生成V1 mL标准状况下的NO气体(假定还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,再向所得溶液中加入V2mL6mol·L-1NaOH溶液,溶液中金属离子恰好完全沉淀,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,测得生成(m+10.2)g沉淀,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加10.2g,则氢氧化镁和氢氧化铜含有氢氧根的质量为10.2g,据此答题。
A.氢氧化镁和氢氧化铜含有氢氧根的质量为10.2g,则氢氧根的物质的量为![]() =0.6mol,则镁和铜的总的物质的量为0.3mol,假设全为镁,质量为0.3mol×24g/mol=7.2g,若全为铜,质量为0.3mol×64g/mol=19.2g,所以参加反应的金属的总质量(m)为7.2g<m<19.2g,故A错误;
=0.6mol,则镁和铜的总的物质的量为0.3mol,假设全为镁,质量为0.3mol×24g/mol=7.2g,若全为铜,质量为0.3mol×64g/mol=19.2g,所以参加反应的金属的总质量(m)为7.2g<m<19.2g,故A错误;
B.根据方程式可知参加反应的n反应(HNO3)=8/3n(金属)=0.3mol×8/3=0.8mol,故B正确;
C.氢氧化镁和氢氧化铜含有氢氧根的质量为10.2g,氢氧根的物质的量为![]() =0.6mol,则镁和铜的总的物质的量为0.3mol,根据电子转移守恒可知生成的NO物质的量为
=0.6mol,则镁和铜的总的物质的量为0.3mol,根据电子转移守恒可知生成的NO物质的量为![]() =0.2mol,则在标准状况下,生成NO的体积V1=0.2mol×22.4L/mol=4.48L,故C正确;
=0.2mol,则在标准状况下,生成NO的体积V1=0.2mol×22.4L/mol=4.48L,故C正确;
D.因为恰好完全反应,则参加反应氢氧化钠的物质的量为0.6mol,需要氢氧化钠溶液体积=![]() =0.1L=100mL,故D错误。
=0.1L=100mL,故D错误。
故选AD。

【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)元素⑩名称为____在周期表中的位置_____。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是____,碱性最强的化合物的电子式是:_____。
(3)用电子式表示素④与⑥的化合物的形成过程:_____,该化合物属于____(填“共价”或“离子”)化合物。
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式_____。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是_______(用离子符号表示)。