题目内容
【题目】甲烷与甲醇(CH3OH,液态)都属于清洁能源,已知每摩尔甲烷完全燃烧生成液态水和 CO2时放出的热量约为 890.3kJ,每摩尔甲醇完全燃烧生成液态水和 CO2 时放出的热量约为 726.0kJ。
(1)相同质量的甲烷与甲醇完全燃烧,生成液态水和 CO2 时放出热量较多的是_____。从共用电子对的偏离情况来看,甲烷分子中的共价键属于_____,甲醇分子的结构可以看成是甲烷分子中的一个H 原子被原子团(—OH)取代而得到,请根据甲烷的电子式写出甲醇分子的电子式_____。
(2)甲醇燃烧的热化学方程式为_____,1mol 甲醇完全燃烧,若生成水蒸气和 CO2 则放出的热量_____726.0kJ(填>、<或=)。
【答案】甲烷 极性键 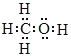 CH3OH(l)+
CH3OH(l)+ ![]() O2(g) = CO2(g)+2H2O(l) ΔH = –726kJ·mol-1 <
O2(g) = CO2(g)+2H2O(l) ΔH = –726kJ·mol-1 <
【解析】
据燃烧时的热量计算等质量甲烷、甲醇燃烧放出的热量;由共用电子对是否偏移判断共价键的类型;据热化学方程式的含义书写热化学方程式,并判断物质状态对反应热的影响。
(1)甲烷与甲醇的相对分子质量分别是16、32,32g甲烷、甲醇完全燃烧放出的热量分别是1780.6kJ、726.0kJ。故相同质量的甲烷与甲醇完全燃烧,甲烷放出热量较多。碳元素非金属性大于氢,碳氢间的共用电子对偏向于碳,故甲烷分子中的共价键属于极性键。甲醇是甲基和羟基组成,甲醇分子的电子式为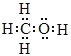 。
。
(2)据题意,甲醇燃烧的热化学方程式为CH3OH(l)+![]() O2(g) = CO2(g)+2H2O(l) ΔH = –726kJ·mol-1;
O2(g) = CO2(g)+2H2O(l) ΔH = –726kJ·mol-1;
因水蒸汽液化放热,1mol 甲醇完全燃烧生成水蒸气时放出的热量小于726.0kJ。

 期末集结号系列答案
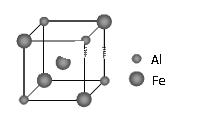
期末集结号系列答案【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)元素⑩名称为____在周期表中的位置_____。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是____,碱性最强的化合物的电子式是:_____。
(3)用电子式表示素④与⑥的化合物的形成过程:_____,该化合物属于____(填“共价”或“离子”)化合物。
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式_____。
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是_______(用离子符号表示)。
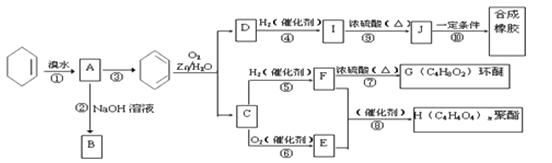
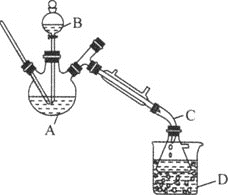
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图![]() 夹持和加热装置已略去
夹持和加热装置已略去![]() 、有关数据和实验步骤如下:
、有关数据和实验步骤如下:
物质 | 相对分子质量 | 密度 | 沸点 | 在水中的溶解性 |
乙醇 | 46 |
| 78 | 互溶 |
乙醚 | 74 |
|
| 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物![]() 。
。
请回答下列问题:
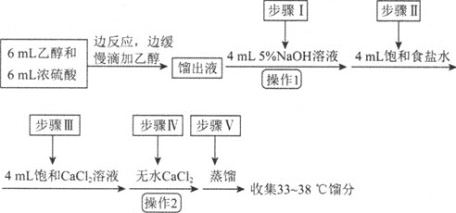
(1)仪器C的名称为_____。
(2)由乙醇制备乙醚的总反应为![]() ,此反应分两步进行,第一步反应的化学方程式为
,此反应分两步进行,第一步反应的化学方程式为![]() ,则第二步反应的化学方程式为_______。
,则第二步反应的化学方程式为_______。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是___。
(4)仪器D中盛有冰水混合物,其作用为___。
(5)操作1的名称为____,操作2的名称为___。
(6)若省略步骤Ⅱ会导致的后果是_______。
(7)若实验过程中共加入18mL乙醇,最终得到8.7g乙醚,则乙醚的产率为______![]() 计算结果精确到
计算结果精确到![]() 。
。