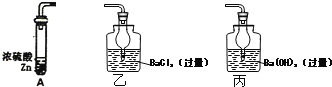��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ���֣�������ŷֱ����ijһԪ�ء���ش��������⡣
(1)�١����У�����õĽ���Ԫ����________(дԪ�ط��ţ���ͬ)������õ�Ԫ����________��
(2)�٢�ļ����ӣ���뾶�������________(д���ӷ���)��
(3)������̬�⻯����ȶ�����____________(�ѧʽ)��
(4)Ԫ�صķǽ����ԣ���________��(����������������)��
(5)�١��������������ˮ�����У�������ǿ����____________(�ѧʽ)��������ǿ����__________(�ѧʽ)���ü���ݵ�����������ˮ���ﷴӦ�����ӷ���ʽΪ__________��
���𰸡�K Ne F�� HF �� HClO4 KOH Al(OH)3��OH��= AlO2-��2H2O
��������
����Ԫ�������ڱ��е�λ�ÿ�֪����ΪNaԪ�أ���ΪKԪ�أ���ΪMgԪ�أ���ΪCaԪ�أ���ΪAlԪ�أ���ΪSiԪ�أ���ΪNԪ�أ���ΪFԪ�أ���ΪClԪ�أ���ΪNeԪ�أ����Ԫ�������ɷ������
(1) ͬһ���ڣ��������ң������Լ�����ͬһ���壬���ϵ��£���������ǿ���١����У�����õĽ���Ԫ����K��ϡ����������ã�����õ�Ԫ����Ne���ʴ�Ϊ��K��Ne��
(2) һ����ԣ����Ӳ���Խ�࣬�뾶Խ���Ӳ�����ͬ��ԭ������Խ�뾶ԽС��
�٢�ļ����ӵ��Ӳ�����ͬ����뾶�������F�����ʴ�Ϊ��F����
(3) �ǽ�����Խǿ����Ӧ�⻯��Խ�ȶ����ǽ�����F��Cl����̬�⻯����ȶ�����HF���ʴ�Ϊ��HF��
(4) ͬһ���ڣ��������ң��ǽ�������ǿ��ͬһ���壬���ϵ��£��ǽ����Լ�����Ԫ�صķǽ����ԣ���(Si)����(N)���ʴ�Ϊ������
(5) ͬһ���ڣ��������ң�Ԫ�صķǽ���������ǿ����ۺ��������������ǿ��ͬһ���壬���ϵ��£�Ԫ�صķǽ�������������ۺ��������������������F�����ۣ��١��������������ˮ�����У�������ǿ����HClO4��ͬһ���ڣ��������ң�Ԫ�صĽ���������������������ˮ����ļ���������ͬһ���壬���ϵ��£�Ԫ�صĽ���������ǿ����Ӧ������������ˮ����ļ�������ǿ��������ǿ����KOH����(Al)������������ˮ����Ϊ�������������߷�Ӧ�����ӷ���ʽΪAl(OH)3��OH��= AlO2-��2H2O���ʴ�Ϊ��HClO4��KOH��Al(OH)3��OH��= AlO2-��2H2O��

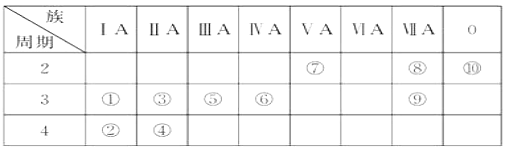
����Ŀ���±���Ԫ�����ڱ���һ����, ��Ա��еĢ١�����Ԫ�أ���д���пհף�
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
��1��Ԫ�آ�����Ϊ____�����ڱ��е�λ��_____��
��2��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��____��������ǿ�Ļ�����ĵ���ʽ�ǣ�_____��
��3���õ���ʽ��ʾ�آ���Ļ�������γɹ��̣�_____���û���������____(����ۡ������ӡ�)�����
��4��д��һ��������Ԫ����ɵļ������Ӽ����зǼ��Թ��ۼ������ʵĻ�ѧʽ_____��
��5���ޡ��ߡ�������Ԫ���γɵ����ӣ����Ӱ뾶�ɴ�С��˳����_______�������ӷ��ű�ʾ����