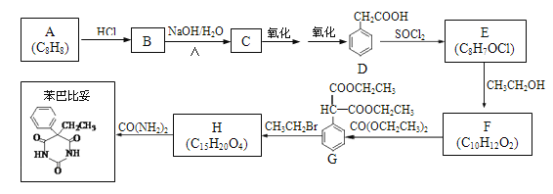
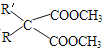
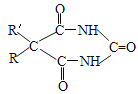
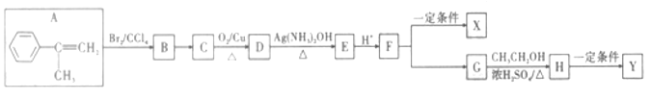
题目内容
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,
试回答下列问题:
(1)写出滴定实验中所发生反应的离子方程式:_________________________________________________________
(2)实验中KMnO4溶液应装在___________式滴定管中,滴定终点的判断依据是_______________________________
(3)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______mol·L-1
(4)若滴定终点读数时目光俯视,则计算出的x值可能_______________(填“偏大”、“偏小”、“无影响”)
(5)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
【答案】2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O 酸 滴入最后一滴KMnO4溶液时,锥形瓶内溶液的颜色恰好由无色变成紫红色,且半分钟内不褪色 ![]() 偏大 D
偏大 D
【解析】
(1)根据滴定实验是向草酸溶液中滴加酸性KMnO4溶液,所发生反应的化学方程式进行分析;
(2)根据实验②中,滴定时,KMnO4溶液应装在酸式滴定管中:原因为KMnO4具有强氧化性,会腐蚀碱式滴定管中的橡皮管进行分析;
(3)根据草酸与KMnO4反应方程式结合题中数据得出;
(4)根据滴定终点时俯视滴定管刻度,会导致测量体积偏小进行分析;
(5)根据选用的滴定指示剂的物质的溶解度及现象明显程度进行分析。
(1)滴定实验是向草酸溶液中滴加酸性KMnO4溶液,所发生反应的化学方程式:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O;故答案为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O。
(2)实验②中,滴定时,KMnO4溶液应装在酸式滴定管中:原因为KMnO4具有强氧化性,会腐蚀碱式滴定管中的橡皮管。滴定终点的判断依据是:滴入最后一滴KMnO4溶液时,锥形瓶内溶液的颜色恰好由无色变成红色,且半分钟内不褪色。故答案为:滴入最后一滴KMnO4溶液时,锥形瓶内溶液的颜色恰好由无色变成紫红色,且半分钟内不褪色。
(3)用去VmL KMnO4溶液,n(KMnO4)=Vc![]() 10-3,由2KMnO4~5H2C2O4,可以知道,待测草酸的物质aV的量浓度为
10-3,由2KMnO4~5H2C2O4,可以知道,待测草酸的物质aV的量浓度为![]() ,故答案为:
,故答案为:![]()
(4)滴定终点时俯视滴定管刻度,会导致测量体积偏小,测定草酸浓度偏小,则x值会偏大,故答案为:偏大。
(5)若用AgNO3去滴定NaSCN溶液,可选用的滴定指示剂的物质的溶解度应比AgSCN大,且现象明显,应为Na2CrO4,混合物中有砖红色沉淀生成,故答案为:D。

 字词句段篇系列答案
字词句段篇系列答案