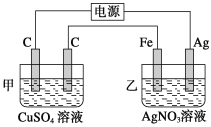
题目内容
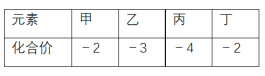
【题目】短周期元素甲、乙、丙、丁的原子半径依次增大,其氢化物中甲、乙、丙、丁的化合价如表所示。下列说法正确的是
A. 氢化物的沸点:甲>丁B. 元素非金属性:甲<乙
C. 含氧酸的酸性:乙 <丁D. 丙的氧化物为离子化合物
【答案】A
【解析】
由短周期元素氢化物中甲、乙、丙、丁的化合价可知,乙处于V族,甲、丁处于ⅥA族,丙处于ⅣA,且甲、乙、丙、丁的原子半径依次增大,则甲为O元素、乙为N元素、丙为C元素、丁为S元素。
A.水分子之间存在氢键,沸点高于H2S,故A正确;
B.同周期自左而右非金属性增强,故非金属性:甲(O)>乙(N),故B错误;
C.非金属性越强,最高价含氧酸的酸性越强,其它含氧酸则不一定,故C错误;
D. 丙为碳,丙的氧化物为共价化合物,故D错误;
故选A。

【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,
试回答下列问题:
(1)写出滴定实验中所发生反应的离子方程式:_________________________________________________________
(2)实验中KMnO4溶液应装在___________式滴定管中,滴定终点的判断依据是_______________________________
(3)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______mol·L-1
(4)若滴定终点读数时目光俯视,则计算出的x值可能_______________(填“偏大”、“偏小”、“无影响”)
(5)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4