题目内容
11.一定条件下在2L的密闭容器中,充入2mol SO2和1molO2发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.6mol时反应达到平衡,下列有关叙述不正确的是( )| A. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为 453.2g | |
| B. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)>v (逆) | |
| C. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为40% | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
分析 一定条件下在2L的密闭容器中,充入2mol SO2和1molO2,当气体的总物质的量减少0.6mol时反应达到平衡,则:
2SO2(g)+O2(g)?2SO3(g) 物质的量减少△n=1
起始量(mol):2 1 0
变化量(mol):1.2 0.6 1.2 0.6
平衡量(mol):0.8 0.4 1.2
A.三氧化硫与氯化钡溶液反应生成硫酸钡沉淀,平衡体系中未反应的二氧化硫、氧气物质的量之比为2:1,再溶液中恰好转化为硫酸,也生成硫酸钡沉淀,根据S元素守恒计算硫酸钡质量;
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,平衡正向移动;
C.相同温度下,起始时向容器中充入2mol SO3与原平衡等效,平衡时相同组分的物质的量相等;
D.保持其他条件不变,若起始时向容器中充入2molSO3,与原平衡等效,平衡时三氧化硫的物质的量相等,可以计算转化的三氧化硫物质的量,结合热化学方程式计算吸收的热量.
解答 解:一定条件下在2L的密闭容器中,充入2mol SO2和1molO2,当气体的总物质的量减少0.6mol时反应达到平衡,则:
2SO2(g)+O2(g)?2SO3(g) 物质的量减少△n=1
起始量(mol):2 1 0
变化量(mol):1.2 0.6 1.2 0.6
平衡量(mol):0.8 0.4 1.2
A.三氧化硫与氯化钡溶液反应生成硫酸钡沉淀,平衡体系中未反应的二氧化硫、氧气物质的量之比为2:1,再溶液中恰好转化为硫酸,也生成硫酸钡沉淀,根据S元素守恒,硫酸钡物质的量为2mol,可以得到沉淀质量为2mol×233g/mol=466g,故A错误;
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,平衡正向移动,则v (正)>v (逆),故B正确;
C.相同温度下,起始时向容器中充入2mol SO3与原平衡等效,平衡时相同组分的物质的量相等,则转化的三氧化硫为2mol-1.2mol=0.8mol,故三氧化硫转化率为$\frac{0.8mol}{2mol}$×100%=40%,故C正确;
D.保持其他条件不变,若起始时向容器中充入2molSO3,与原平衡等效,平衡时三氧化硫的物质的量相等,转化的三氧化硫为2mol-1.2mol=0.8mol,故吸收的热量为196kJ•moL-1×$\frac{0.8mol}{2mol}$=78.4kJ,故D正确,
故选:A.
点评 本题考查化学平衡计算,注意CD选项运用等效平衡解答,A选项为易错点,学生容易考查三氧化硫反应生成硫酸钡沉淀,忽略二氧化硫、氧气在溶液中转化为硫酸后也可以生成硫酸钡.

①在反应体系中加入催化剂,反应速率增大,该反应的反应热不变(填“增大”、“减小”或“不变”).
②5分钟后达到平衡,测得N2为0.2mol,H2为0.6mol,NH3为0.2mol.氮气的平均反应速率v(N2)=0.01mol•L-1•min-1,H2的转化率为33.3%(保留小数点后一位).
③欲提高②容器中H2的转化率,下列措施可行的是AD.
A.把气体的体积压缩至1L B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
2N2(g)+6H2O(l)4NH3(g)+3O2(g)△H=a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 汽车尾气和燃煤尾气是造成空气污染的原因之一.
汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是AD.
A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3 D.容器内压强保持不变
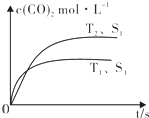
(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
①该反应的△H>0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.
若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)将MnO4-氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+;=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是:生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的是F.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G、H形成的化合物中,最稳定的HF.
(5)在B、C、E、F、G、H中,原子半径最大的是Na.
(6)A和D组成最简单化合物的电子式
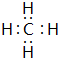 .
.(7)A和E组成化合物的化学式NH3等.
(8)用电子式表示B和H组成化合物的形成过程
 .
.(9)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| A. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| B. | 减少直至不使用对大气臭氧层起破坏作用的氟氯烃 | |
| C. | 大量开采地下水,以满足社会对水的需求 | |
| D. | 节约能源,提高能利用率 |
 碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题:
碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题: