题目内容
17. 二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置.
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是氯气与硫合成二氯化硫的实验装置.试回答下列问题:
(1)装置A中发生反应的化学方程式为MnO2 +4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B应盛放的药品是饱和食盐水,C中是浓硫酸.
(3)实验开始前先在D中放一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是增大反应的接触面积.
(4)实验时,D装置需加热至50-59℃.最好采用水浴 方式加热.如何防止E中液体挥发将锥形瓶放人冰水中冷却.
(5)二氯化硫分子中各原子均为8电子稳定结构,其电子式为
 ,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.
,由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2.(6)在配制一定物质的量浓度的盐酸溶液时,下列操作所配溶液浓度偏低的是CD:
A.配制溶液时,容量瓶中有少量水.
B.使用容量瓶配制溶液时,俯视观察溶液凹液面与容量瓶刻度线相切
C.配制溶液的过程中,容量瓶未塞好,洒出一些溶液.
D.发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线.
分析 A用于制备氯气,发生MnO2+2Cl-+4H+ $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,B、C用于除杂,分别除去氯化氢和水,实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,可增大硫与氯气的接触面积,利于充分反应,因二氯化硫遇水易分解,F用于防止空气中的水蒸气进入装置,并吸收氯气防止污染环境,以此解答该题.
(1)A用于制备氯气,发生MnO2+2Cl-+4H+ $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)制得的氯气不纯,混有氯化氢和水,应除去;
(3)由粉末状变为一薄层,增大了反应接触面积,能加快反应速率,使反应充分;
(4)实验时,D装置需加热至50-59℃介于水浴温度0-100℃,最好采用水浴加热的方式,冷却用冰水冷却;
(5)二氯化硫分子中各原子均为8电子稳定结构,形成的化合物为共价化合物,据此书写电子式,二氯化硫与SO3作用生成亚硫酰氯和二氧化硫;
(6)在配制一定物质的量浓度的盐酸溶液时,依据不足溶液消耗体积的变化分析判断误差,结合c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析.
解答 解:(1)实验室用浓盐酸与二氧化锰加热制备氯气,反应的化学方程式为MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2 +4HCl $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)实验室用二氧化锰和浓盐酸制取氯气,浓盐酸易挥发,所以制得的氯气不纯,混有氯化氢和水,除去氯化氢用饱和食盐水,浓硫酸具有吸水性,除水用浓硫酸,
故答案为:饱和食盐水;浓硫酸;
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,可增大硫与氯气的接触面积,利于充分反应,能加快反应速率,
故答案为:增大反应的接触面积;
(4)实验时,D装置需加热至50-59℃介于水浴温度0-100℃,采用水浴加热的方式,二氯化硫(SCl2)熔点-78℃,可以将锥形瓶放入冰水中冷却,防止E中液体二氯化硫(SCl2)挥发,
故答案为:水浴加热;将锥形瓶放入冰水中冷却;
(5)二氯化硫分子中各原子均为8电子稳定结构,形成的化合物为共价化合物,据此书写电子式为: ,根据元素守恒可知,二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2 ,故答案为:
,根据元素守恒可知,二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2 ,故答案为: ,SCl2+SO3=SOCl2+SO2;
,SCl2+SO3=SOCl2+SO2;
(6)结合c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析选项,
A.配制溶液时,容量瓶中有少量水,对所配溶液浓度没有影响;
B.使用容量瓶配制溶液时,俯视观察溶液凹液面与容量瓶刻度线相切,使得溶液的体积偏小,则所得溶液浓度偏高;
C.配制溶液的过程中,容量瓶未塞好,洒出一些溶液,所配溶液浓度减小;
D.发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度,所得溶液浓度偏低,
故答案为:C、D.
点评 本题考查阅读获取信息的能力、对实验原理理解等,为高频考点,侧重学生的分析、实验能力的考查,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,注意题中信二氯化硫遇水易分解为解答关键,题目难度中等.

 快捷英语周周练系列答案
快捷英语周周练系列答案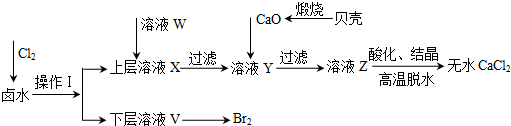
(1)操作Ⅰ使用的试剂是四氯化碳,所用的主要仪器名称是分液漏斗.
(2)加入溶液W的目的是除去溶液中的SO42-.用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择的pH最大范围是11.0≤pH<12.2.酸化溶液Z时,使用的试剂为盐酸.
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |
 汽车尾气和燃煤尾气是造成空气污染的原因之一.
汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是AD.
A.容器中密度不变 B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3 D.容器内压强保持不变
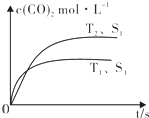
(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
①该反应的△H>0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.
若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥容量瓶 ⑦蒸发皿 ⑧坩埚.
| A. | ①③⑤⑥ | B. | ①②④⑥ | C. | ①③⑤⑦ | D. | ①③⑥⑧ |
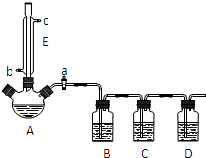 某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.
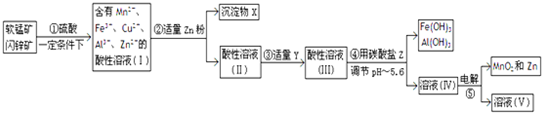
某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃. 碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题:
碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题: