题目内容
14.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| B. | 17.4 g某硫化磷(如图)中含P-S键数目为0.6NA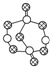 | |
| C. | 1 mol含8个碳原子的某烃分子,最多形成7 mol碳碳单键 | |
| D. | 标准状况下,22.4 L SO2与O2混合气体,含有2NA个氧原子 |
分析 A、该反应中双氧水的化合价为-1价,生成1mol氧气转移了2mol电子;
B、根据图示判断硫化磷分子组成及分子中含有的P-S键数目,然后再计算出17.4g硫化磷中含有的P-S键数目;
C、依据碳原子的最外层电子数是4,可以形成四个单键分析;
D、SO2与O2均含2个氧原子.
解答 解:A、32g氧气的物质的量为1mol,在H2O2+Cl2═2HCl+O2反应中,双氧水中-1价氧元素被氧化成0价氧气,生成1mol氧气转移了2mol电子,转移2NA个电子,故A错误;
B、S的非金属性强于P,所以S的化合价为-2价,根据图示可知,黑球为S,白球为P原子,硫化磷分子式为P4S7,17.4g硫化磷的物质的量为:$\frac{17.4g}{348g/mol}$=0.05mol,而1molP4S7中含13molP-S键,故0.05molP4S7分子中含有0.065molP-S键,含有P-S键数目为0.065NA,故B错误;
C、1mol含8个碳原子的某烃分子,当形成环状结构时,可以形成8molC-C单键,即8mol碳原子最多形成8mol碳碳键,故C错误;
D、标况下,22.4 L SO2与O2混合气体的物质的量为1mol,而SO2与O2均含2个氧原子,故无论在混合物中两者所占的比例如何,1mol混和气体中一定含2mol氧原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子,根据以上叙述,下列说法正确的是( )
| A. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | W与Y可形成既含极性共价键又含有非极性共价键的化合物 | |
| D. | XW4一定高于YW3的稳定性 |
2.下列有关的离子方程式书写正确的是( )
| A. | 向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| B. | 服用阿司匹林过量出现水杨酸( )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: +2 HCO3-→+2 CO2↑+2 H2O +2 HCO3-→+2 CO2↑+2 H2O | |
| C. | 20mL 1.0mol/L的明矾溶液与10mL 3.5mol/LBa(OH)2溶液混合充分反应:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
9.已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期.X和Y能形成两种常见共价化合物,Z能与X形成两种常见的离子化合物,阴、阳离子个数比均为1:2.下列说法错误的是( )
| A. | Y、Z、X、W的原子序数依次减小 | |
| B. | X的简单氢化物的沸点低于Y的简单氢化物的沸点 | |
| C. | 由W、X、Y、Z四种元素组成的化合物可能显强酸性 | |
| D. | W和X形成的化合物,与W和Y形成的化合物中各元素质量比可能相同 |
19.下列物质分类正确的是( )
| A. | NO2、Cl2O7都是酸性氧化物 | B. | 水银、水玻璃都是混合物 | ||
| C. | HD、HCHO都是极性分子 | D. | 干冰、可燃冰都是分子晶体 |
6.如图所示图象,不能正确反映其对应变化关系的是( )
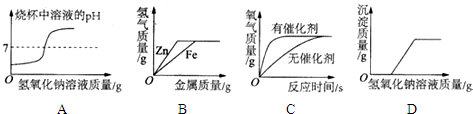

| A. | 向盐酸中逐渐滴加氢氧化钠溶液 | |
| B. | 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| C. | 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| D. | 向一定质量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
3.在某个容积为2L的密闭容器内,在T℃时按下图所示发生反应2A(g)+B(g)?3D(g)+E(s)△H<0.下列措施能增大B的转化率的是( )


| A. | 再投入2molA和1molB | B. | 保持体积不变通入1molB | ||
| C. | 移出部分物质B | D. | 再投入2molA,1molB和0.6molD |
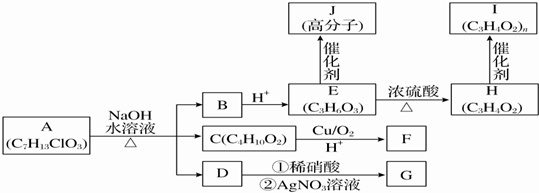
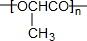 .
.