题目内容
【题目】在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L。
(1)求该反应的平衡常数______。
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度______。
【答案】0.25 c(H2)=c(I2)=0.016 mol/L,c(HI)=0.0080 mol/L
【解析】
(1)起始时H2的物质的量浓度为0.010mol/L,平衡时为0.0080 mol/L,所以消耗的H2为0.0020mol/L。可以用三段式求平衡常数:
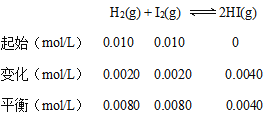
该反应的平衡常数![]() ;
;
(2)在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,通入的H2和I2蒸气的物质的量是原来的2倍,可以看做是在原平衡的基础上增大了压强。由于该反应前后气体系数之和相等,所以增大压强,平衡不移动,所以平衡时各物质的物质的量浓度是原平衡的2倍,即物质的量浓度为c(H2)=c(I2)=0.016mol/L,c(HI)=0.0080mol/L。

【题目】硫代硫酸钠(![]() )是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生
)是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生![]() 和
和![]() 。
。
实验Ⅰ.![]() 的制备。工业上可用反应:
的制备。工业上可用反应:![]() 制得,实验室模拟该工业过程的装置如图所示。
制得,实验室模拟该工业过程的装置如图所示。

(1)仪器a的名称是__________,仪器b的名称是_____________。b中利用质量分数为70%~80%的![]() 溶液与
溶液与![]() 固体反应制备
固体反应制备![]() 反应的化学方程式为_______________________。c中试剂为________。
反应的化学方程式为_______________________。c中试剂为________。
(2)实验中要控制![]() 的生成速率,可以采取的措施有_________________________(写出一条)。
的生成速率,可以采取的措施有_________________________(写出一条)。
(3)为了保证硫代硫酸钠的产量,实验中通入的![]() 不能过量,原因是_________________________。
不能过量,原因是_________________________。
实验Ⅱ.探究![]() 与金属阳离子的氧化还原反应。
与金属阳离子的氧化还原反应。
资料:![]() (紫黑色)
(紫黑色)
装置 | 试剂X | 实验现象 |
|
| 混合后溶液先变成紫黑色,30s后溶液几乎变为无色 |
(4)根据上述实验现象,初步判断最终![]() 被
被![]() 还原为
还原为![]() ,通过________________________(填操作、试剂和现象),进一步证实生成了
,通过________________________(填操作、试剂和现象),进一步证实生成了![]()