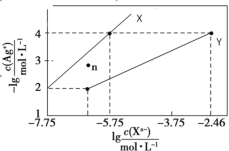
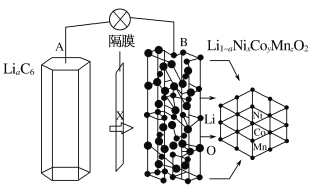
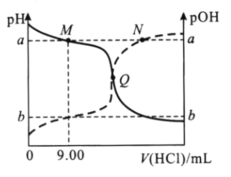
题目内容
【题目】氧化还原反应原理在研究物质性质及物质转化方面具有重要的的价值。
(1)化合价是学习氧化还原反应的基础。在括号中写出以下几种物质中划线元素的化合价。
NaI(____) ClO3-(____) K2MnO4 (___) Br2(___)
(2)1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将其与浓盐酸混合加热,产生黄绿色气体,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应(或者还原反应)的理由_______。
MnCl2+Cl2↑+2H2O。从反应物中任选一种物质,说明其发生氧化反应(或者还原反应)的理由_______。
【答案】-1 +5 +6 0 Mn的化合价由MnO2中的+4价降低为MnCl2中的+2价,MnO2发生还原反应;或者Cl的化合价从HCl中的-1价升高为Cl2中的0价,HCl发生氧化反应
【解析】
(1)根据单质的化合价为0,化合物中正负化合价之和为0,离子随带电荷数=离子中个元素化合价之和来分析;
(2)根据氧化还原反应的规律分析,结合反应物中元素的化合价变化分析。
(1)根据单质的化合价为0,化合物中正负化合价之和为0,离子随带电荷数=离子中个元素化合价之和;NaI中,设碘元素的化合价为x,钠离子为+1价,则x+1=0,碘元素的化合价为-1价; ClO3-中,设氯元素的化合价为x,氧元素为-2价,则-1=(-2)×3+x,则x=+5,氯元素的化合价为+5价;K2MnO4 中,设锰元素的化合价为x,钾元素的化合价为+1价,氧元素的化合价为-2价,则(+1)×2+x+(-2)×4=0,则x=+6,锰元素的化合价为+6;Br2为单质,则溴元素的化合价为0,故答案为:-1;+5;+6;0;
(2)反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,Mn的化合价由MnO2中的+4价降低为MnCl2中的+2价,MnO2发生还原反应;或者Cl的化合价从HCl中的-1价升高为Cl2中的0价,HCl发生氧化反应,故答案为:Mn的化合价由MnO2中的+4价降低为MnCl2中的+2价,MnO2发生还原反应;或者Cl的化合价从HCl中的-1价升高为Cl2中的0价,HCl发生氧化反应。
MnCl2+Cl2↑+2H2O,Mn的化合价由MnO2中的+4价降低为MnCl2中的+2价,MnO2发生还原反应;或者Cl的化合价从HCl中的-1价升高为Cl2中的0价,HCl发生氧化反应,故答案为:Mn的化合价由MnO2中的+4价降低为MnCl2中的+2价,MnO2发生还原反应;或者Cl的化合价从HCl中的-1价升高为Cl2中的0价,HCl发生氧化反应。

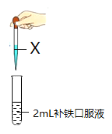
【题目】某研究小组同学对市售某种补铁口服液的成分进行探究。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。

I.设计方案如下:
| 方案 | 试剂X | 预期现象 |
方案i | 1mL 1 mol/L NaOH溶液 | a | |
方案ii | 1mL 1 mol/L 酸性KMnO4溶液 | b | |
方案iii | 依次加入5滴KSCN溶液、1mL氯水 | c |
(1)方案i的预期现象是产生白色沉淀,逐渐变为灰绿色,最终变为红褐色。产生白色沉淀的离子方程式是_________,最终变为红褐色的化学方程式是________。
(2)方案ii的预期现象是_________。
(3)方案iii的预期现象是________,反应中氯水参与反应的的离子方程式是____。
II.进行实验操作,得到的实际现象如下:
方案 | 实际现象 | 是否与预期现象相同 |
方案i | 产生灰绿色浑浊,长时间不变红褐色 | 不同 |
方案ii | 相同 | |
方案iii | 自始至终无明显现象 | 不同 |
(4)为探究实验中出现异常现象的原因,该小组同学查看说明书,得知有关补铁口服液成分的如下:
本品每毫升含主要成分葡萄糖酸亚铁30毫克,
辅料为:蔗糖、香精、枸檬酸、羟苯乙酯。
结合资料对异常现象产生的原因进行猜想:______________;为验证其猜想,在方案iii的基础上继续加入过量的氯水,得到了预期的现象。
(5) 实验反思:方案ii中预期现象与实验现象相同,并不能证明补铁口服液中一定含有Fe2+,理由是______。
(6)小组同学进一步提出研究问题:仍选用之前用过的试剂,设计实验验证某久置的补铁口服液(计为Y
实验序号 | 操作 | 现象 |
ⅳ | 取2 mL溶液Y,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
V |
实验V的操作及现象是_____________。