题目内容
【题目】铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。请完成列空白:
(1)铝元素在周期表中的位置为_____
(2)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6mol电子时,所得气体的物质的量为_____mol
(3)双羟基铝碳酸钠[NaAl(OH)2CO3]是一种常用的抗酸药,它和胃酸反应的化学方程式为_____
(4)如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:
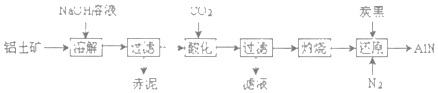
①“溶解”时,SiO2与NaOH溶液反应生成的硅酸钠与溶液中偏铝酸钠发生反应:2Na2SiO3+2NaAIO2+2H2O═Na2Al2Si2O8↓+4NaOH,赤泥的主要成分为_____(写出化学式)。
②“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3滤液的主要成分为_____(写化学式)。
③“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_____
【答案】第三周期,第ⅢA主族 3 NaAl(OH)2CO3+4HCl=NaCl+AlCl3+3H2O+CO2↑ Fe2O3、Na2Al2Si2O8 NaHCO3 Al2O3+N2+3C![]() 2AlN+3CO
2AlN+3CO
【解析】
(1)铝是13号元素,核电荷数13,核外电子数为13,核外三个电子层,最外层3个电子,确定铝元素在周期表中的位置;
(2)铝和氢氧化钠反应的化学方程式分析判断,还原产物为氢气,结合反应定量关系计算;
(3)[NaAl(OH)2CO3]和盐酸反应生成氯化钠、氯化铝、二氧化碳和水;
(4)铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质),铝士矿中加入氢氧化钠溶液,SiO2和Al2O3溶于氢氧化钠溶液,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH,氧化铁不溶于氢氧化钠溶液,所以过滤得赤泥为Fe2O3、Na2Al2Si2O8,滤液主要为偏铝酸钠溶液,偏铝酸钠溶液中通入过量的二氧化碳酸化得沉淀为氢氧化铝,过滤得滤液主要为NaHCO3溶液,氢氧化铝燃烧得氧化铝,氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO。
(1)铝是13号元素,核电荷数13,核外电子数为13,核外三个电子层,最外层3个电子铝元素在周期表中的位置为第三周期,第ⅢA主族,故答案为:第三周期,第ⅢA主族;
(2)铝和氢氧化钠反应的化学方程式分析,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,还原产物为氢气,当反应转移6mol电子时,所得还原产物的物质的量为3mol,故答案为:3;
(3)[NaAl(OH)2CO3]和盐酸反应生成氯化钠、氯化铝、二氧化碳和水,反应的方程式为NaAl(OH)2CO3+4HCl=NaCl+AlCl3+3H2O+CO2↑,故答案为:NaAl(OH)2CO3+4HCl=NaCl+AlCl3+3H2O+CO2↑;
(4)铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质),铝士矿中加入氢氧化钠溶液,SiO2和Al2O3溶于氢氧化钠溶液,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH,氧化铁不溶于氢氧化钠溶液,所以过滤得赤泥为Fe2O3、Na2Al2Si2O8,滤液主要为偏铝酸钠溶液,偏铝酸钠溶液中通入过量的二氧化碳酸化得沉淀为氢氧化铝,过滤得滤液主要为NaHCO3溶液,氢氧化铝燃烧得氧化铝,氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO,
①根据上面的分析可知,赤泥的主要成分为 Fe2O3、Na2Al2Si2O8,故答案为:Fe2O3、Na2Al2Si2O8;
②“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为 NaHCO3,故答案为:NaHCO3;
③氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO,反应的化学方程式为Al2O3+N2+3C![]() 2AlN+3CO,故答案为:Al2O3+N2+3C
2AlN+3CO,故答案为:Al2O3+N2+3C![]() 2AlN+3CO。
2AlN+3CO。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案