题目内容
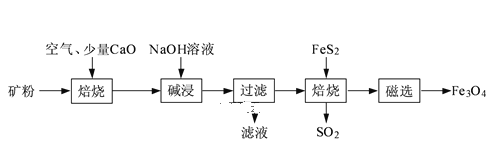
【题目】硫代硫酸钠(![]() )是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生
)是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生![]() 和
和![]() 。
。
实验Ⅰ.![]() 的制备。工业上可用反应:
的制备。工业上可用反应:![]() 制得,实验室模拟该工业过程的装置如图所示。
制得,实验室模拟该工业过程的装置如图所示。

(1)仪器a的名称是__________,仪器b的名称是_____________。b中利用质量分数为70%~80%的![]() 溶液与
溶液与![]() 固体反应制备
固体反应制备![]() 反应的化学方程式为_______________________。c中试剂为________。
反应的化学方程式为_______________________。c中试剂为________。
(2)实验中要控制![]() 的生成速率,可以采取的措施有_________________________(写出一条)。
的生成速率,可以采取的措施有_________________________(写出一条)。
(3)为了保证硫代硫酸钠的产量,实验中通入的![]() 不能过量,原因是_________________________。
不能过量,原因是_________________________。
实验Ⅱ.探究![]() 与金属阳离子的氧化还原反应。
与金属阳离子的氧化还原反应。
资料:![]() (紫黑色)
(紫黑色)
装置 | 试剂X | 实验现象 |
|
| 混合后溶液先变成紫黑色,30s后溶液几乎变为无色 |
(4)根据上述实验现象,初步判断最终![]() 被
被![]() 还原为
还原为![]() ,通过________________________(填操作、试剂和现象),进一步证实生成了
,通过________________________(填操作、试剂和现象),进一步证实生成了![]()
【答案】分液漏斗 蒸馏烧瓶 ![]() 硫化钠和碳酸钠的混合溶液 调节酸的滴加速度 若
硫化钠和碳酸钠的混合溶液 调节酸的滴加速度 若![]() 过量,溶液显酸性,产物会发生分解 取少量反应后的溶液于试管中,加入铁氰化钾溶液,产生蓝色沉淀
过量,溶液显酸性,产物会发生分解 取少量反应后的溶液于试管中,加入铁氰化钾溶液,产生蓝色沉淀
【解析】
利用浓硫酸和亚硫酸钠固体反应制取二氧化硫,通入盛有硫化钠和碳酸钠的混合溶液的三颈烧瓶中进行反应制取硫代硫酸钠,由于硫代硫酸钠在酸性环境中容易分解,所以通入的二氧化硫不能过,装置d可以用来吸收尾气。
(1)仪器a的名称是分液漏斗,仪器b的名称是蒸馏烧瓶,b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为H2SO4+Na2SO3=SO2↑+H2O+Na2SO4,c装置为Na2S2O3的生成装置,根据反应原理可知c中的试剂为:硫化钠和碳酸钠的混合溶液;
(2)可以通过控制反应的温度或硫酸的滴加速度可以控制SO2生成速率;
(3)硫代硫酸钠遇酸易分解,若通入的SO2过量,则溶液显酸性,硫代硫酸钠会分解;
(4)实验①的现象是混合后溶液先变成紫黑色,30s后溶液几乎变为无色,取反应后的混合液并加入铁氰化钾溶液,产生蓝色沉淀,则有Fe2+生成,可判断为Fe3+被S2O32-还原为Fe2+。

【题目】某研究小组同学对市售某种补铁口服液的成分进行探究。根据名称认为该糖浆中含有Fe2+,设计方案进行验证。

I.设计方案如下:
| 方案 | 试剂X | 预期现象 |
方案i | 1mL 1 mol/L NaOH溶液 | a | |
方案ii | 1mL 1 mol/L 酸性KMnO4溶液 | b | |
方案iii | 依次加入5滴KSCN溶液、1mL氯水 | c |
(1)方案i的预期现象是产生白色沉淀,逐渐变为灰绿色,最终变为红褐色。产生白色沉淀的离子方程式是_________,最终变为红褐色的化学方程式是________。
(2)方案ii的预期现象是_________。
(3)方案iii的预期现象是________,反应中氯水参与反应的的离子方程式是____。
II.进行实验操作,得到的实际现象如下:
方案 | 实际现象 | 是否与预期现象相同 |
方案i | 产生灰绿色浑浊,长时间不变红褐色 | 不同 |
方案ii | 相同 | |
方案iii | 自始至终无明显现象 | 不同 |
(4)为探究实验中出现异常现象的原因,该小组同学查看说明书,得知有关补铁口服液成分的如下:
本品每毫升含主要成分葡萄糖酸亚铁30毫克,
辅料为:蔗糖、香精、枸檬酸、羟苯乙酯。
结合资料对异常现象产生的原因进行猜想:______________;为验证其猜想,在方案iii的基础上继续加入过量的氯水,得到了预期的现象。
(5) 实验反思:方案ii中预期现象与实验现象相同,并不能证明补铁口服液中一定含有Fe2+,理由是______。
(6)小组同学进一步提出研究问题:仍选用之前用过的试剂,设计实验验证某久置的补铁口服液(计为Y
实验序号 | 操作 | 现象 |
ⅳ | 取2 mL溶液Y,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
V |
实验V的操作及现象是_____________。