题目内容
在一百多种化学元素中,非金属占了23种。80%的非金属元素在社会中占重要位置。如C、N、O、Si、Cl等。
(1)氯元素原子最外电子层上有 种能量不同的电子,该元素的简单阴离子核外电子排布式是 。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,因为它属于 晶体,请写出该化合物的化学式 。
(3)下列事实能说明氯与氧两元素非金属性相对强弱的有 。(选填编号)
a.Cl原子最外层电子数比氧多
b.酸性:HCl>H2O
c.ClO2中氯元素为+4价,氧元素为?2价
d.沸点:H2O>HCl
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2 +HCl ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)
(4)上述方程式中,缺项物质是___________,配平方程式,并在下面补全反应物系数。____NaClO2 +____HCl
(5)该反应中氧化剂和还原剂的物质的量之比是 。生成0.2 mol ClO2转移电子的物质的量为_______ mol。
(6)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN-a mg/L,现用ClO2将CN-氧化,只生成两种无毒气体。处理100m3这种污水,至少需要ClO2 _______ mol 。
(1)2 1s22s22p63s23p6
(2)原子 Si3N4
(3)c
(4)NaCl H2O (漏写不给分) 5NaClO2 +4HCl
(5)1∶4 0.2
(6) (或3.85a)
(或3.85a)
解析试题分析:(1)氯元素原子最外电子层电子排布式为3S2P5,共有2种能量不同的电子,该元素的简单阴离子核外电子排布式是[Ne]3S23P6。
(2)由氮元素与硅元素组成的物质,可用于制造发动机的耐热部件,说明熔点很高,属于原子晶体,根据化合价,该化合物的化学式 Si3N4。
(3)a.不能通过Cl原子最外层电子数比氧多,只能通过得电子的难易来说明,错误;b应是最高价氧化物对应水化物的酸性强弱对比,而不是氢化物水溶液的酸性对比,错误;c.ClO2中氯元素为+4价,氧元素为?2价,说明氧得电子强于氯,故氯显正价,正确;d.沸点不能说明,错误;
(4)根据化合价升降法和原子守恒,5 NaClO2 +4HCl 4ClO2↑+5NaCl+ 2H2O 。
4ClO2↑+5NaCl+ 2H2O 。
(5)该反应中氧化剂和还原剂都是NaClO2,两者物质的量之比是1:4。生成0.2 mol ClO2转移电子的物质的量为 0.2 mol。
(6)根据题中信息,写出2ClO2+2CN-→2CO2 + N2+ 2Cl-根据电子守恒,ClO2 与CN-物质的量相等,即为 (或3.85a)。
(或3.85a)。
考点:本题主要考查氧化还原的配平,电子守恒法相关计算。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O
当反应中有2.408×1024个电子发生转移时,还原剂的质量为
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)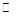 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | x | 2.0 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2.0 | 1.0 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为 (要求2位有效数字,下同);实验2达到平衡时CO的体积分数为 。
②若反应的平衡常数大,处理CO的效率高,则增大该反应平衡常数的措施有 。
③900℃时,该密闭容器中,加入4 molCO,3 mol H2O ,4mol CO2和2.4mol H2,比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
④一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的有 。
A.容器中气体的平均分子量不随时间而变化
B.消耗1molH2的同时消耗1molCO
C.容器中气体的密度不随时间而变化
D.CO2的体积分数不随时间而变化
(3)汽车尾气的排放对空气造成污染。目前采用的是在汽车排气装置中安装一个净化器,可以有效将尾气中的有害气体转化。如:
①CO (g)+NO2(g) =CO2(g) + NO (g) ΔH =-a kJ/mol (a>0)
② 2CO (g)+2NO(g) =2CO2(g) )+ N2 (g) ΔH =-b kJ/mol (b>0)
若用标准状况下3.36LCO还原NO2至N2(CO完全反应)时放出的热量为 kJ(用含a和b的代数式表示,下同);并写出该反应的热化学方程式 。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:____________________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________;处理100 m3这种污水,至少需要ClO2________mol。
现有一未配平的氧化还原反应:
KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X
(1)该反应的还原剂是_________。
(2)已知0.2 mol KClO3在反应中得到1 mol电子生成X,则X的化学式是__________。
(3)根据上述反应可推知__________________(填写序号)。
| A.氧化性:KClO3>H3PO4 | B.氧化性:H3PO4>KClO3 |
| C.还原性:PH3>X | D.还原性:X>PH3 |
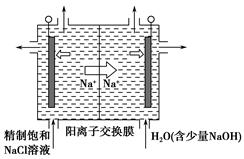
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
请同答下列问题:
(l)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_______ FeO42-+_______ H2O="_______" Fe(OH)3(胶体)+_______O2↑+_______OH-。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为________。

(6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为________ 。
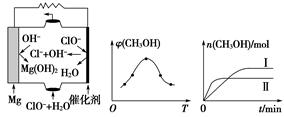
 CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。 2Cu+SO2
2Cu+SO2