题目内容
实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中氧化剂是_____________,还原剂是__________________。
(2)若反应中有0.20 mol 电子发生转移,生成氯气的体积为 (标准状况),被氧化的HCl的物质的量是 。
(1) KMnO4 , HCl ;(2)2.24L , 0.20 mol。
解析试题分析:在反应2KMnO4+16HCl(浓) ="==" 2KCl+2MnCl2+5Cl2↑+8H2O中,化合价的变化: Mn由KMnO4中的+7价——MnCl2是+2价,化合价降低,得到电子,被还原,发生还原反应,作氧化剂;Cl由HCl的-1价——Cl2的0价,化合价升高,失去电子,被氧化,反应氧化反应,作还原剂。产生5molCl2,转移电子10mol。若转移电子0.20mol,则产生氯气为0.1mol,在标准状况下体积为2.24L。这时被氧化的HCl的物质的量为0.20mol。
考点:考查氧化还原反应中氧化剂、还原剂等概念及电子转移的数目与产生的气体的体积的关系的知识。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案I. 今有H2、Cl2混合气100 mL(标况),其中一种气体的体积为45mL。光照使两种气体发生反应后恢复到标况,气体体积为 mL。为了说明反应后气体中H2或Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后恢复到标况,
(1)若仍剩余___mL,证明有___剩余,理由是_____;
(2)若溶液有___性质,证明有___剩余,理由是________________________。
II.一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图所示)。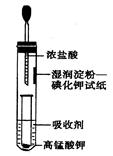
(1)下列溶液能吸收Cl2的是________。
| A.饱和食盐水 | B.Na2SO4溶液 |
| C.NaOH溶液 | D.浓硫酸 |
(3)实验室制取氯气的离子方程式__________________________。
 ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)