��Ŀ����
����̼ѭ������������ĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ����ԡ���̼���á�����Ϊ��ѧ���о�����Ҫ���⡣
��1���õ绡���ϳɵĴ�������̼�ܳ����д�����̼�����������ʣ������ֿ������������������ᴿ������ɸ÷�Ӧ�Ļ�ѧ����ʽ��(����ƽ���ϵ�����ں�����)
__ C+ __ KMnO4+ ___ H2SO4��___CO2��+ ___MnSO4 + ___K2SO4+ ___H2O
����Ӧ����2��408��1024�����ӷ���ת��ʱ����ԭ��������Ϊ
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2 L�ĺ����ܱ������У����з�ӦCO��g����H2O��g�� CO2��g����H2��g�����õ������������ݣ�
CO2��g����H2��g�����õ������������ݣ�
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | x | 2��0 | 1��6 | 2��4 | 6 |
| 2 | 900 | 2��0 | 1��0 | 0��4 | 1��6 | 3 |
��ʵ��1����v(CO2����ʾ�ķ�Ӧ����Ϊ (Ҫ��2λ��Ч���֣���ͬ)��ʵ��2�ﵽƽ��ʱCO���������Ϊ ��
������Ӧ��ƽ�ⳣ������CO��Ч�ʸߣ�������÷�Ӧƽ�ⳣ���Ĵ�ʩ�� ��
��900��ʱ�����ܱ������У�����4 molCO��3 mol H2O ��4mol CO2��2��4mol H2���Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v�� ______ v�� �������������������)��
��һ��������������Ӧ��ij����̶����ܱ������н��У���˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���� ��
A�������������ƽ������������ʱ����仯
B������1molH2��ͬʱ����1molCO
C��������������ܶȲ���ʱ����仯
D��CO2�������������ʱ����仯
��3������β�����ŷŶԿ��������Ⱦ��Ŀǰ���õ�������������װ���а�װһ����������������Ч��β���е��к�����ת�����磺
��CO (g)+NO2(g) ��CO2(g) + NO (g) ��H ����a kJ��mol (a��0)
�� 2CO (g)+2NO(g) ��2CO2(g) )+ N2 (g) ��H ����b kJ��mol (b��0)
���ñ�״����3��36LCO��ԭNO2��N2(CO��ȫ��Ӧ)ʱ�ų�������Ϊ kJ(�ú�a��b�Ĵ���ʽ��ʾ����ͬ)����д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��1��5��4��6��5��4��2��6 ��2�֣��� 12g ��2�֣�
��2���� 0��13 mol��L-l�� min-l��2�֣��� 0�� 53��2�֣�
�� �����¶ȣ�2�֣� �� ����2�֣� ��B D��2�֣�
��3�� 3(2a+b)/80��2�֣� ��
4CO (g)+2NO2(g) ��4CO2(g) )+ N2 (g) ��H��-(2a+b) kJ��mol ��2�֣�
���������������1�����ݻ��ϼ���������ƽ�÷�Ӧ�������������Ԫ�ػ��ϼ۽���5�ۣ�̼Ԫ�ػ��ϼ�����4�ۣ����ϼ����������ڻ��ϼ۽����������Ը������ǰ��ϵ����4��̼����ǰ��ϵ����5������ԭ���غ㣬��ƽ�������ʵ�ϵ������ƽ���£�5 C+ 4 KMnO4+ 6 H2SO4�T 5CO2�� + 4MnSO4 + 2 K2SO4+ 6 H2O���÷�Ӧת�Ƶ�������20������Ӧ����2��408��1024�����ӷ���ת��ʱ����ԭ��̼��������Ϊm���� �����m="12" g ��
�����m="12" g ��
��2����ʵ��1�дﵽƽ��ʱ����CO2�����ʵ�������H2�����ʵ���Ϊ1��6mol������v(CO2)= =0��13 mol��L-l�� min-l��
=0��13 mol��L-l�� min-l��
ʵ��2�ﵽƽ��ʱCO�������������ɸ������η����£�
CO(g)+H2O(g)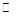 H2(g)+CO2(g)
H2(g)+CO2(g)
��ʼ��/mol 2��0 1��0 0 0
ת����/mol 0��4 0��4 0��4 0��4
ƽ����/mol 1��6 0��6 0��4 0��4
ʵ��2�ﵽƽ��ʱCO���������Ϊ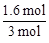 =0��53��
=0��53��
�ڸ������η������ͬ�¶��µ�ƽ�ⳣ����K(650��)= ��K(900��)=
��K(900��)=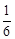 �������¶�ƽ�ⳣ����С����֪�����¶�ƽ�������ƶ����ָı�ѹǿ�Ը÷�Ӧƽ����Ӱ�죬��������÷�Ӧƽ�ⳣ���Ĵ�ʩֻ���ǽ����¶�ʹƽ�������ƶ���
�������¶�ƽ�ⳣ����С����֪�����¶�ƽ�������ƶ����ָı�ѹǿ�Ը÷�Ӧƽ����Ӱ�죬��������÷�Ӧƽ�ⳣ���Ĵ�ʩֻ���ǽ����¶�ʹƽ�������ƶ���
�۸������µ�Ũ�Ȼ�Qc= =0��8��K(900��)��ƽ�����淴Ӧ�����ƶ�����v�� ��v����
=0��8��K(900��)��ƽ�����淴Ӧ�����ƶ�����v�� ��v����
��A���÷�ӦΪ���巴Ӧ����Ӧǰ�������ʵ������䣬���������غ㣬���������ƽ������������ʱ����仯������B������1 mol H2��ͬʱ����1 mol CO�����������淴Ӧ������ȣ���ȷ��C���̶�������ܱ��������������䣬������䣬�����ܶ�Ҳ���ı䣬����D��CO2�������������ʱ����仯����ȷ��
��3�����ݸ�˹���ɣ���+�� 2�õ���
2�õ���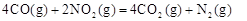 ��H="-(2a+b)kJ/mol" ��3��36 L CO��ԭNO2��N2ʱ�ų�������Ϊ
��H="-(2a+b)kJ/mol" ��3��36 L CO��ԭNO2��N2ʱ�ų�������Ϊ ��
��
���㣺������ԭ��Ӧ����ƽ�ͼ��㣬��ѧ��Ӧ���ʼ��㣬ƽ��״̬��־���жϣ���ѧƽ��ļ��㣬��˹���ɵļ��㡣

 7N2��12 H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������ L��
7N2��12 H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������ L�� 2SO3��g�� ��H="-196.6" kJ��mol-1
2SO3��g�� ��H="-196.6" kJ��mol-1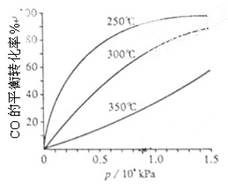
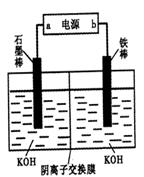
 Fe(OH)3��5OH��]
Fe(OH)3��5OH��]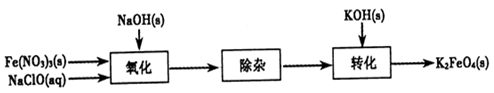

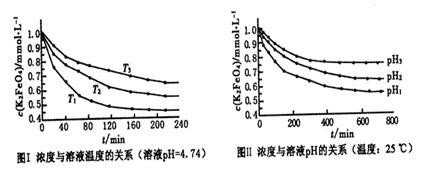
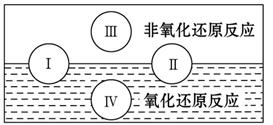
 �÷�Ӧ�У�____________Ԫ�ر���ԭ���÷�Ӧ���������ͻ�ԭ�����ʵ���֮��Ϊ__________��
�÷�Ӧ�У�____________Ԫ�ر���ԭ���÷�Ӧ���������ͻ�ԭ�����ʵ���֮��Ϊ__________��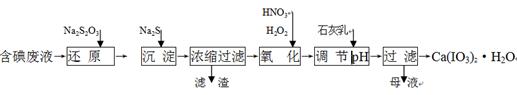
 _____Cu+_____CuCl2+N2��+_____H2O��
_____Cu+_____CuCl2+N2��+_____H2O�� ClO2��+___________________��û����ƽ��
ClO2��+___________________��û����ƽ��