题目内容
7.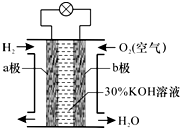 氢氧燃料电池是一种将化学能转化为电能的高效、环境友好的发电装置.该电池的构造如图所示,下列分析判断错误的是( )
氢氧燃料电池是一种将化学能转化为电能的高效、环境友好的发电装置.该电池的构造如图所示,下列分析判断错误的是( )| A. | a极为负极,b极为正极 | |
| B. | 负极发生氧化反应 | |
| C. | 正极的电极反应为O2+2H2O+2e-═4OH- | |
| D. | 负极的电极反应为H2+2OH--2e-═2H2O |
分析 氢氧燃料电池工作时,是把化学能转变为电能,通入氢气的一极为电源的负极,发生氧化反应,在碱性氢氧燃料电池中负极电极反应式为2H2+4OH--4e-=4H2O,通入氧气的一极为原电池的正极,电极反应式为O2+2H2O+4e-=4OH-,电子由负极经外电路流向正极,和电流的流向相反,据此回答.
解答 解:A、通入氢气的电极为负极,通入氧气的电极为正极,故A正确;
B、通入氢气的一极为电源的负极,发生氧化反应,故B正确;
C、通入氧气的一极为原电池的正极,电极反应式为O2+2H2O+4e-=4OH-,故C错误;
D、在碱性氢氧燃料电池中负极电极反应式为H2+2OH--2e-=2H2O,故D正确;
故选C.
点评 本题考查氢氧燃料电池的工作原理,题目难度不大,注意正负极的判断及电极反应式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列分子中的α键是由两个原子的p轨道以“头碰头”方式重叠构建而成的是( )
| A. | CCl4 | B. | Cl2 | C. | H2 | D. | HF |
15.下列氧化物不能跟铝粉组成铝热剂的是( )
| A. | Fe2O3 | B. | MnO2 | C. | CaO | D. | V2O5 |
12.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 蛋白质和蔗糖都属于高分子化合物,一定条件下都能水解 | |
| C. | 乙烯水化成乙醇,原子利用率为百分之百,符合绿色化学原理 | |
| D. | 淀粉与纤维素互为同分异构体 |
19.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,根据原电池原理判断下列叙述正确的是( )
| A. | 负极反应:H2-2e-═2 H+ | |
| B. | 通O2的一极是发生还原反应 | |
| C. | 工作一段时间后电解质溶液的c(OH-)增大 | |
| D. | 工作时负极区附近pH增大 |
16.下列有关能量变化的说法中错误的是( )
| A. | 化学反应必伴随能量变化 | |
| B. | 反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小 | |
| C. | Ba(OH)2•8H2O和NH4Cl(固体)混合搅拌发生的是吸热反应 | |
| D. | 燃煤发电不需经过其它能量转换过程,可直接把化学能转化为电能 |
17.原子晶体干冰具有类似SiO2的晶体结构,下列有关它的推断中,错误的是( )
| A. | 它可作耐磨材料 | |
| B. | 它不可用作致冷剂 | |
| C. | 晶体中每个碳原子形成2个碳氧双键 | |
| D. | 晶体中碳、氧原子个数之比为1:2 |
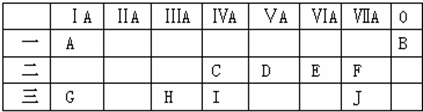
 ,元素H与元素J组成的化合物的水溶液中加入少量烧碱溶液,反应的离子方程式为Al3++3OH-=Al(OH)3↓.
,元素H与元素J组成的化合物的水溶液中加入少量烧碱溶液,反应的离子方程式为Al3++3OH-=Al(OH)3↓. .
.