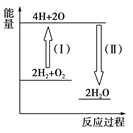
题目内容
【题目】在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g) ![]() 2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
A | B | |||
Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
Ⅱ | 800℃ | 1.5 mol | 0.5 mol | ____ |
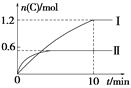
A. 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B. 上述方程式中a=160
C. 600℃时,该反应的平衡常数是0.45
D. 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
【答案】D
【解析】A、10 min时实验Ⅰ达到平衡,C的物质的量为1.2mol,所以v(C)=1.2mol÷2L÷10min=0.06 mol·L-1·min-1,根据物质的化学反应速率之比等于物质的化学计量数之比可得v(B)=v(C)/2=0.03 mol·L-1·min-1,A错误;B、实验Ⅰ中生成1.2molC时热量变化为96 kJ,则生成2molC时热量变化值为2/1.2×96 kJ=160 kJ,从平衡Ⅰ到平衡Ⅱ,温度升高,C的物质的量减小,平衡逆向移动,逆反应为吸热反应,所以正反应为放热反应,故a=-160,B错误;C、实验Ⅰ中平衡时,C的物质的量为1.2mol,浓度为0.6mol/L,A的物质的量为1mol-0.6mol=0.4mol,浓度为0.2mol/L,B的物质的量为3mol-0.6mol=2.4mol,浓度为1.2mol/L,D为固体,不计算在平衡常数中,所以K=0.62/(0.2×1.2)=1.5,C错误;D、该反应前后气体的分子数不变,温度不变时,不同情况下只要反应物的投料比例相同,就可以达到等效平衡,实验Ⅱ中充入的A和B的物质的量的比为3:1,将再充入0.5 mol A和0.5/3 mol B放入另一个容器中,两种情况可构成等效平衡, A的转化率相同,现在将再充入的0.5 mol A和0.5/3 mol B压入原容器中,相当于增压,平衡不移动,最后再将多余的1.5mol-0.5/3mol=4/3mol的B气体再压入原容器,B的农度增大,平衡正向移动,A的转化率增大,D正确。正确答案为D。

【题目】I、在下列物质转化中A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外的同一种元素。请回答:
(1)A的化学式是______, Z的电子式是______。
(2)当X是强酸时,写出C→D的化学方程式:_____。
(3)当X是强碱时,写出E的稀溶液和铜反应生成C的离子方程式:_____。
II、在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (其相对分子质量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(4)为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是____(填字母代号)。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(5)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
①上表中第一次实验中记录数据明显大于后两次,其原因可能是_____(填字母代号)。
A.滴定前滴定管尖嘴无气泡,滴定结束有气泡
B.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
D.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
②通过实验数据计算的该产品纯度为_____(用字母a、c表示)。