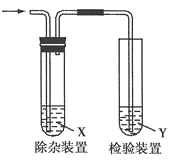
题目内容
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 4.0 g H218O中所含电子数为2 NA
B. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
C. 将含0.1mol FeCl3的饱和溶液滴入沸水中,形成的胶体粒子的数目为0.1NA
D. 含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
【答案】A
【解析】4.0 g H218O中所含电子数![]() 2NA,故A正确;1个H2O2分子中含2个极性共价键,0.1 mol H2O2分子中含极性共价键数目为0.2NA,故B错误;胶粒是氢氧化铁的聚合体,将含0.1mol FeCl3的饱和溶液滴入沸水中,形成的胶体粒子的数目小于0.1NA,故C错误;铜与稀硫酸不反应,含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA,故D错误。
2NA,故A正确;1个H2O2分子中含2个极性共价键,0.1 mol H2O2分子中含极性共价键数目为0.2NA,故B错误;胶粒是氢氧化铁的聚合体,将含0.1mol FeCl3的饱和溶液滴入沸水中,形成的胶体粒子的数目小于0.1NA,故C错误;铜与稀硫酸不反应,含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA,故D错误。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
【题目】在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g) ![]() 2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
A | B | |||
Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
Ⅱ | 800℃ | 1.5 mol | 0.5 mol | ____ |
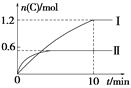
A. 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B. 上述方程式中a=160
C. 600℃时,该反应的平衡常数是0.45
D. 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大