题目内容
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)此反应的热化学方程式为_______________________________________。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1 N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 气态肼和二氧化氮反应的热化学方程式为_______________________________。
(5)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
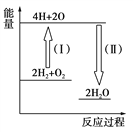
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
【答案】 N2H4(l) + 2H2O2(l)=N2(g) + 4H2O(g) ΔH=-640 kJ·mol-1 408 不产生污染性物质 2N2H4(g) +2NO2(g)== 3N2(g)+4H2O(g) ΔH=-1000.3 kJ·mol-1 放出 1852
【解析】(1)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量,则1mol液态肼放出的热量为256kJ/0.4mol=640kJ·mol-1,所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ·mol-1;(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ·mol-1;②H2O(g)===H2O(l) ΔH=-44 kJ·mol-1;依据盖斯定律①+②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-816kJ·mol-1,而16g液态肼物质的量为0.5mol,与液态双氧水反应生成液态水时放出的热量=0.5mol×816kJ·mol-1=408kJ;(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 不产生污染性物质;(4)已知:①N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ·mol-1 , ②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 ,依据盖斯定律②×2-①得到,气态肼和二氧化氮反应的热化学方程式为:2N2H4(g) +2NO2(g)== 3N2(g)+4H2O(g) ΔH=-1000.3 kJ·mol-1;(4)形成化学键放出能量,反应过程(Ⅱ)代表形成了2mol水,即4molH-O放出的能量,因此放出能量为4×463kJ=1852kJ。

【题目】在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g) ![]() 2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
A | B | |||
Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
Ⅱ | 800℃ | 1.5 mol | 0.5 mol | ____ |
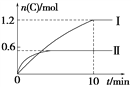
A. 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B. 上述方程式中a=160
C. 600℃时,该反应的平衡常数是0.45
D. 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大