题目内容
把足量的铁粉投入到溶解有硫酸和硫酸铜的溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为
| A.1:4 | B.2:7 | C.1:2 | D.3:8 |
A
掌握“差量法”的运用
铁粉发生的反应为(设硫酸铜、硫酸分别为xmol、ymol):
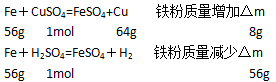
依题意可知:8x=56y,即x:y=7:1
则可计算出原溶液中H+与SO42-的物质的量浓度之比为:2×1:(7+1)=1:4
答案为A
铁粉发生的反应为(设硫酸铜、硫酸分别为xmol、ymol):

依题意可知:8x=56y,即x:y=7:1
则可计算出原溶液中H+与SO42-的物质的量浓度之比为:2×1:(7+1)=1:4
答案为A

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
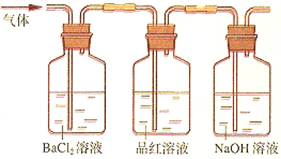
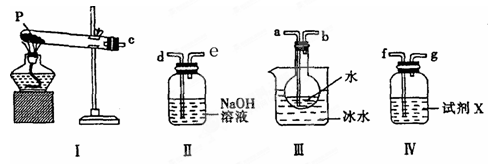
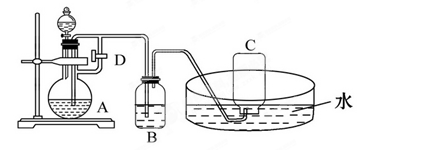
 应预先加入的试剂是________,A中反应的离子方程式为____________________________________________________。
应预先加入的试剂是________,A中反应的离子方程式为____________________________________________________。