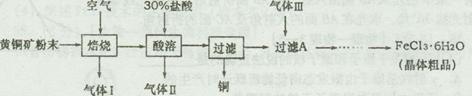
题目内容
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。已知Fe + 2Fe3+= 3Fe2+,Cu + 2Fe3+= 2Fe2++Cu2+。则原混合物中单质铁的质量是( )
| A.2.4 g | B.3.36 g | C.5.60 g | D.10.08 g |
C
因有固体残余,没有Fe3+;故溶液只有FeCl2和过量HCl;根据氯离子守恒有n(FeCl2)=(0.1L×4.4mo/L-0.2L×0.4mol/L)÷2=0.18mol。产生氢气为0.04mol,故与之反应的铁为0.04mol;因有氢离子剩余,故1.28g为铜,与之反应的铁为0.02mol;在反应Fe + 2Fe3+= 3Fe2+中生成的Fe2+为0.18-0.04-0.02=0.12mol;则反应的铁为0.04mol。共有铁为0.04+0.04+0.02=0.1mol。

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目