题目内容
【题目】甲醇燃料电池容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源。如图是甲醇的质子交换膜型燃料电池模型,下列有关说法正确的是( )
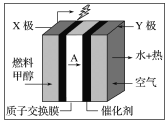
A.Y极为电池的负极
B.X极的电极反应式:CH3OH+H2O-6e-=CO2+6H+
C.若常温下用该电池电解100 mL KCl溶液至pH=12时,电池质子交换膜迁移的A为0.01 mol
D.空气以20%为氧气计算,X极每消耗1 mol甲醇,Y极必消耗168 L空气中的氧气
【答案】B
【解析】
根据质子移动方向知,X为负极、Y为正极,负极上电极反应式为CH3OH+H2O-6e-=CO2+6H+,正极电极反应式为O2+4e-+4H+=2H2O,结合转移电子相等进行计算。
A.放电时,电解质溶液中氢离子向正极移动,根据质子移动方向可知,Y为正极,故A错误;
B.X电极为负极,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH+H2O-6e-=CO2+6H+,故B正确;
C.根据2KCl+2H2O ![]() 2KOH+H2↑+Cl2↑知,若常温下以该电池电解100mLKCl溶液至PH=12时,生成n(KOH)=0.01mol/L×0.1L=0.001mol,根据KOH和氢离子之间的关系式知,电池质子交换膜迁移的A为0.001mol,故C错误;
2KOH+H2↑+Cl2↑知,若常温下以该电池电解100mLKCl溶液至PH=12时,生成n(KOH)=0.01mol/L×0.1L=0.001mol,根据KOH和氢离子之间的关系式知,电池质子交换膜迁移的A为0.001mol,故C错误;
D.温度和压强未知,无法计算氧气或空气的准确体积,故D错误;
故答案为B。

 优加精卷系列答案
优加精卷系列答案【题目】重铬酸钠(Na2Cr2O72H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
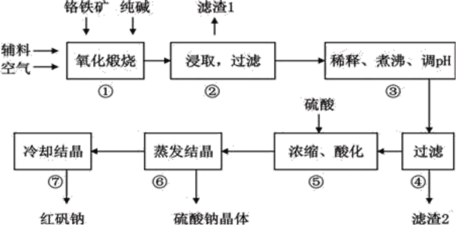
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是__________________;
(2)③中调节pH至4.7,目的是__________________;
(3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:__________________;
(4)⑦中采用冷却结晶的方法析出红矾钠,依据是_________________________ ;
(5)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__________________mol·L-1,后续废水处理方能达到排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。