题目内容
6.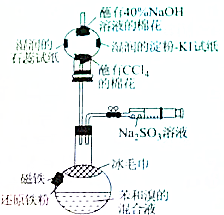 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应,实验步骤如下:
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应,实验步骤如下:Ⅰ、按图所示组装仪器并检查装置的气密性;
Ⅱ、将磁铁用双面胶固定在圆底烧瓶外侧顶部,取0.5g还原铁粉置于瓶内,移动烧瓶使铁粉被磁铁吸于瓶内侧顶端,在干燥管球内尖端部位放一团蘸有40%氢氧化钠溶液的棉花,两侧分别放一段湿润的石蕊试纸和湿润的淀粉碘化钾试纸,再将另一团蘸有CCl4的棉花松松地置于干燥管的管口,塞上带有导管的胶塞.
Ⅲ、用注射器加入溴和苯的混合溶液7.5mL(体积比约为1:2),塞上胶塞,稍微倾斜一下烧瓶并移去磁铁,铁粉自然落入溴和苯的混合溶液中,将一块冰毛巾覆盖在圆底烧瓶上半部分,混合液开始处于微沸状态,1min后转为沸腾.
IV、反应完毕后,打开止水夹,立即将注射器中10mL饱和的亚硫酸钠溶液注入烧瓶内,充分反应后,上层为浅绿色溶液,下层为接近无色油状液体,再用注射器注入蒸馏水“水洗”,即可清楚地看到无色溴苯生成,请回答相关问题:
(1)步骤Ⅱ中蘸有CCl4的棉花和蘸有40%氢氧化钠溶液的棉花的作用分别为吸收挥发苯与溴、吸收HBr,防止污染环境;
(2)步骤Ⅲ中,苯和溴反应的化学反应方程式为
 ;冰毛巾覆盖在圆底烧瓶上半部分的目的降低温度圆底烧瓶上部温度,起冷却回流作用;
;冰毛巾覆盖在圆底烧瓶上半部分的目的降低温度圆底烧瓶上部温度,起冷却回流作用;(3)步骤Ⅳ中,饱和的亚硫酸钠溶液的主要作用是消耗掉未反应的溴,防止污染环境,生成浅绿色溶液的离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,从“水洗”后的体系中分离出溴苯的操作是分液;
(4)什么现象能证明苯和溴发生的是取代反应湿润的淀粉-KI试纸无明显现象,湿润的石蕊试纸变红色;
(5)该实验的优点有防止造成环境污染、实验同时证明苯和溴发生的是取代反应等.
分析 (1)苯与溴易挥发,用四氯化碳吸收;反应生成HBr,用NaOH溶液吸收,防止污染环境;
(2)苯与溴在Fe作催化剂条件下反应生成溴苯与HBr;反应放出热量,溴与苯都易挥发,用冰毛巾覆盖在圆底烧瓶上半部分,降低温度圆底烧瓶上部温度,起冷却回流作用;
(3)亚硫酸钠具有还原性,可以消耗掉未反应的溴;反应中起催化剂作用物质实际是FeBr3,三价铁具有氧化性,可以与亚硫酸钠发生氧化反应生成亚铁离子、硫酸根;溴苯与水溶液不互溶,利用分液的方法进行分离;
(4)利用湿润的淀粉-KI试纸排除溴使湿润的石蕊试变色,再利用湿润的石蕊试纸验证有HBr;
(5)该实验防止环境污染、实验同时可以证明苯和溴发生的是取代反应.
解答 解:(1)苯与溴易挥发,用四氯化碳吸收,防止对环境污染、防止溴对HBr检验的影响,由于反应生成HBr,且易挥发,用NaOH溶液吸收,防止污染环境,
故答案为:吸收挥发苯与溴;吸收HBr,防止污染环境;
(2)苯与溴在Fe作催化剂(实际为溴化铁)条件下反应生成溴苯与HBr,反应方程式为: ;反应放出热量,溴与苯都易挥发,用冰毛巾覆盖在圆底烧瓶上半部分,降低温度圆底烧瓶上部温度,起冷却回流作用,减少原料的损失,
;反应放出热量,溴与苯都易挥发,用冰毛巾覆盖在圆底烧瓶上半部分,降低温度圆底烧瓶上部温度,起冷却回流作用,减少原料的损失,
故答案为: ;降低温度圆底烧瓶上部温度,起冷却回流作用;
;降低温度圆底烧瓶上部温度,起冷却回流作用;
(3)亚硫酸钠具有还原性,可以消耗掉未反应的溴,防止污染环境;反应中起催化剂作用物质实际是FeBr3,三价铁具有氧化性,可以与亚硫酸钠发生氧化反应生成亚铁离子、硫酸根,反应离子方程式为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;溴苯与水溶液不互溶,从“水洗”后的体系中分离出溴苯的操作是分液,
故答案为:消耗掉未反应的溴,防止污染环境;2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;分液;
(4)湿润的淀粉-KI试纸无明显现象,湿润的石蕊试纸变红色,说明反应生成HBr,可以证明证明苯和溴发生的是取代反应,
故答案为:湿润的淀粉-KI试纸无明显现象,湿润的石蕊试纸变红色;
(5)该实验的优点有:防止造成环境污染、实验同时证明苯和溴发生的是取代反应等,
故答案为:防止造成环境污染、实验同时证明苯和溴发生的是取代反应等.
点评 本题考查制备实验方案,侧重对操作的分析评价考查,明确原理是解题关键,是对学生综合能力的考查,难度中等.

| A. | 原子半径:Y>Z>R>T | |
| B. | 气态氢化物的稳定性:W<R<T | |
| C. | 最高价氧化物对应的水化物的碱性:X>Z | |
| D. | XR2、WR2两种化合物中R的化合价相同 |
| A. | 在Cl2与NaOH溶液的反应中,每0.1molCl2参加反应时,转移电子的数目为0.2NA | |
| B. | 0.1mol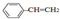 中含有双键的数目为0.4NA 中含有双键的数目为0.4NA | |
| C. | 标准状况下,11.2L乙醇中含有羟基的数目为0.5NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
| A. | 在CH3COONa溶液中,滴加酚酞变红:CH3COO-+H2O═CH3COOH+OH- | |
| B. | 在H2O2溶液中,滴加FeCl3溶液产生气泡:2H2O2+2Cl-═2H2O+O2↑+Cl2↑ | |
| C. | 将相互接触的铜片和锌片置于稀硫酸中,铜片表面有气泡产生:Cu+2H+═Cu2++H2↑ | |
| D. | 向Cu(OH)2悬浊液中滴加Na2S溶液,蓝色沉淀变黑色:Cu(OH)2(s)+S2- (aq)?CuS(s)+2OH- (aq) |
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在透明溶液中:Na+、Cu2+、SO42-、NO3- | |
| C. | 在c(H+)=10-13 mol/L的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| A. | 1 mol Cl2通入含有1 mol FeBr2的溶液中:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| B. | 用两根铜棒作电极电解盐酸:2H-+2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.

 .
. .
.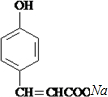 +
+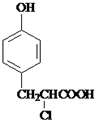 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.