题目内容
1.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 在Cl2与NaOH溶液的反应中,每0.1molCl2参加反应时,转移电子的数目为0.2NA | |
| B. | 0.1mol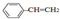 中含有双键的数目为0.4NA 中含有双键的数目为0.4NA | |
| C. | 标准状况下,11.2L乙醇中含有羟基的数目为0.5NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
分析 A、氯气与氢氧化钠的反应为歧化反应;
B、苯环不是单双键交替的结构;
C、标况下,乙醇为液态;
D、NO2和N2O4的最简式为NO2.
解答 解:A、氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,故0.1mol氯气转移0.1mol电子,即0.1NA个,故A正确;
B、苯环不是单双键交替的结构,故1mol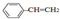 中含1mol双键,故0.1mol
中含1mol双键,故0.1mol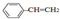 中含0.1mol双键,即0.1NA个,故B正确;
中含0.1mol双键,即0.1NA个,故B正确;
C、标况下,乙醇为液态,故不能根据气体摩尔体积来计算,故C错误;
D、NO2和N2O4的最简式为NO2,故4.6gNO2和N2O4的混合物中含有的NO2的物质的量n=$\frac{4.6g}{46g/mol}$=0.1mol,故含有0.2mol氧原子,即0.2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示.已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 气态氢化物的稳定性:X>Z | |
| C. | Z、W均可与Mg形成离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>W |
12.短周期元素R、T、X、Y、Z在元素周期表的相对位置如图所示,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VA族 | |
| B. | R能分别与X、Z形成共价化合物 | |
| C. | 气态氢化物稳定性:Y>T | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
16.某化合物的结构式(键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位:ppm):

下列关于该有机物的叙述正确的是( )

下列关于该有机物的叙述正确的是( )
| A. | 该有机物不同化学环境的氢原子有4种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能够发生取代反应 |
13.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )


| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:Y>Z>X | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
10.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
(1)①的元素符号是Li;
(2)②和③两种元素相比较,原子半径较小的是:N(填元素符号)
(3)⑥和⑦的气态氢化物中,最稳定的是HCl(填化学式)
(4)写出④的单质与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | Be | ② | ③ | Ne | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | |||||
(2)②和③两种元素相比较,原子半径较小的是:N(填元素符号)
(3)⑥和⑦的气态氢化物中,最稳定的是HCl(填化学式)
(4)写出④的单质与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
 b.
b. c.
c.
 b.
b. c.CH3OCH3
c.CH3OCH3 b.
b. c.
c.
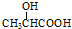 )有良好的防腐保鲜功效,广泛应用于食品行业.
)有良好的防腐保鲜功效,广泛应用于食品行业.
 ,
, .
.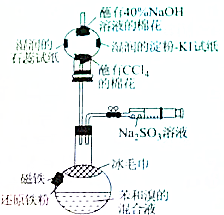 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应,实验步骤如下:
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应,实验步骤如下: ;冰毛巾覆盖在圆底烧瓶上半部分的目的降低温度圆底烧瓶上部温度,起冷却回流作用;
;冰毛巾覆盖在圆底烧瓶上半部分的目的降低温度圆底烧瓶上部温度,起冷却回流作用;