题目内容
15.下列离子方程式正确的是( )| A. | 1 mol Cl2通入含有1 mol FeBr2的溶液中:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| B. | 用两根铜棒作电极电解盐酸:2H-+2Cl-电解_H2↑+Cl2↑ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
分析 A.等物质的量反应时,亚铁离子全部被氧化,溴离子一半被氧化;
C.两根铜棒作电极,阳极Cu失去电子;
C.漏写碳酸氢根离子与碱的反应;
D.反应生成AgCl沉淀.
解答 解:A.1 mol Cl2通入含有1 mol FeBr2的溶液中的离子反应为2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2,故A正确;
B.用两根铜棒作电极电解盐酸的离子反应为Cu+2H+电解_H2↑+Cu2+,故B错误;
C.NH4HCO3溶液与过量NaOH溶液反应的离子反应为HCO3-+NH4++2OH-═NH3•H2O+CO32++H2O,故C错误;
D.向银氨溶液中加入足量的盐酸的离子反应为[Ag(NH3)2]++OH-+Cl-+3H+═AgCl↓+2NH4++H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应考查,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列有关物质分类正确的是( )
| A. | CuO、MgO、Na2O2均属于碱性氧化物 | B. | 盐酸、醋酸、苯酚均属于强电解质 | ||
| C. | CO2、CCl4、蛋白质均属于有机物 | D. | 液氯、晶体硅、臭氧均属于单质 |
10.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
(1)①的元素符号是Li;
(2)②和③两种元素相比较,原子半径较小的是:N(填元素符号)
(3)⑥和⑦的气态氢化物中,最稳定的是HCl(填化学式)
(4)写出④的单质与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
| 族 周期 | IA | 0 | |||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
| 2 | ① | Be | ② | ③ | Ne | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | |||||
(2)②和③两种元素相比较,原子半径较小的是:N(填元素符号)
(3)⑥和⑦的气态氢化物中,最稳定的是HCl(填化学式)
(4)写出④的单质与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
20.室温下,将0.2mol•L-1的一元酸HA和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列说法不正确的是( )
| A. | 0.1mol•L-1 HA溶液与0.1 mol•L-1的NaOH溶液中,水电离出来的c(H+)相等 | |
| B. | 混合后溶液中:c(HA)>c(Na+)>c(A-)>c(OH-) | |
| C. | 混合后溶液中:c(A-)+c(HA)=0.2 mol•L-1 | |
| D. | 混合后溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) |
7.过氧乙酸(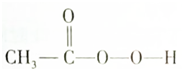 )是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )
)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )
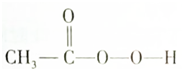 )是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )
)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )| A. | 过氧乙酸溶液与碳酸钙反应能产生二氧化碳气体 | |
| B. | 过氧乙酸与乙醇能发生酯化反应 | |
| C. | 过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 | |
| D. | 由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应 |
5.0.1mol下列气体分别与1L0.1mol•L-1的NaOH溶液反应,形成的溶液pH最小的是( )
| A. | NO2 | B. | SO2 | C. | SO3 | D. | CO2 |
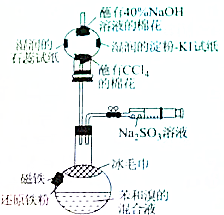 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应,实验步骤如下:
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应,实验步骤如下: ;冰毛巾覆盖在圆底烧瓶上半部分的目的降低温度圆底烧瓶上部温度,起冷却回流作用;
;冰毛巾覆盖在圆底烧瓶上半部分的目的降低温度圆底烧瓶上部温度,起冷却回流作用;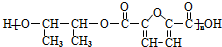 的合成路线如图所示:
的合成路线如图所示: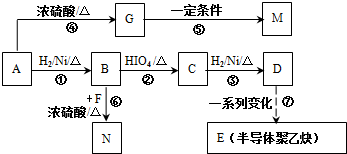
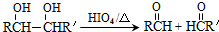
 .
. .
.