题目内容
16.2mol A与2mol B混合于2L的密闭容器中发生反应,2A(g)+3B(g)?2C(g)+3D(g),2s后测得A的物质的量为1mol,求:(1)2s时C的浓度;
(2)A、B、C、D各自的反应速率;
(3)A的转化率;
(4)C的体积分数;
(5)起始与平衡时压强之比.
分析 (1)根据三行式求C的物质的量的变化量,然后求2s时C的浓度;
(2)根据v=△nV△t△nV△t计算A表示的反应速率,然后根据速率之比等于对应物质的化学计量数之比,求其它物质的速率;
(3)A的转化率=变化量起始量×100;
(4)C的体积分数等于C的物质的量分数,而反应前后气体的计量数相等;
(5)因为反应前后气体的计量数相等,所以起始与平衡时压强之比为1:1.
解答 解:2A(g)+3B(g)?2C(g)+3D(g)
初起量:2mol 2mol 0 0
变化量:1mol 1.5mol 1mol 1.5mol
2s后:1mol 0.5mol 1mol 1.5mol
(1)2s时C的浓度为:1mol2L=0.5mol/L,答:2s时C的浓度为0.5mol/L;
(2)v(A)=△nV△t=1mol2L2s=0.25mol•L-1•min-1,所以v(B)=0.37525mol•L-1•min-1,v(C)=0.25mol•L-1•min-1,v(D)=0.37525mol•L-1•min-1,答:A、B、C、D各自的反应速率分别为:0.25mol•L-1•min-1,0.37525mol•L-1•min-1,0.25mol•L-1•min-1,0.37525mol•L-1•min-1;
(3)A的转化率=变化量起始量×100=1mol2mol×100%=50%,答:A的转化率为:50%;
(4)C的体积分数等于C的物质的量分数14×100%=25%,答:C的体积分数为:25%;
(5)因为反应前后气体的计量数相等,所以起始与平衡时压强之比为1:1,答:起始与平衡时压强之比为1:1.,
点评 本题考查化学平衡的计算,题目难度不大,注意速率公式利用及根据方程式的计算,注重基础知识的积累.

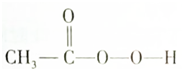 )是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )
)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒、细菌和真菌.下列有关过氧乙酸的叙述中不正确的是( )| A. | 过氧乙酸溶液与碳酸钙反应能产生二氧化碳气体 | |
| B. | 过氧乙酸与乙醇能发生酯化反应 | |
| C. | 过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 | |
| D. | 由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应 |
| A. | C99H200 | B. | CO | C. | NaHCO3 | D. | CH3COOCH2CH3 |
| A. | NO2 | B. | SO2 | C. | SO3 | D. | CO2 |

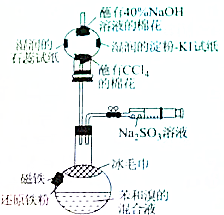 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应,实验步骤如下:
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应,实验步骤如下: ;冰毛巾覆盖在圆底烧瓶上半部分的目的降低温度圆底烧瓶上部温度,起冷却回流作用;
;冰毛巾覆盖在圆底烧瓶上半部分的目的降低温度圆底烧瓶上部温度,起冷却回流作用;
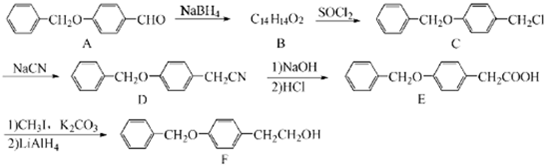
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应. .
. 为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO
为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO