题目内容
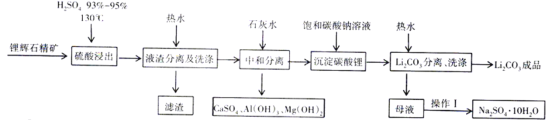
【题目】JohnB.Goodenough等三位科学家因为在锂离子电池研究领域的突出贡献获得2019年诺贝尔化学奖。碳酸锂是一种常见的锂离子电池原料,一种以锂辉石为原料制取碳酸锂的工艺如图:(锂辉石:LiAl(SiO3)2,也表示为Li2O·Al2O3·4SiO2,还含微量的钠、钙、镁等元素)
[查阅资料]:Li2CO3为无色单斜晶系结晶体,熔点618℃,溶于硫酸,微溶于水,在冷水中的溶解度比热水中大。
(1)在“硫酸浸出”流程,将硫酸加热到130℃的目的是___________________________。
(2)工业上高温煅烧FePO4、Li2CO3和草酸晶体(H2C2O4·2H2O)的混合物制取电池材料磷酸亚铁锂(LiFePO4),反应的化学方程式为__________________________________。
(3)LiFePO4含有Fe、Li两种金属元素,它们的焰色反应的颜色分别是___________
A.黄色、紫红色B.绿色、黄色C.无焰色反应、紫红色D.黄色、无焰色反应
(4)在“Li2CO3分离、洗涤”流程,用热水洗涤的原因是___________________________。
(5)某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。
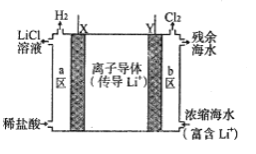
电池中的Y电极为________(填“正极”或“负极”或“阳极”或“阴极”)。X极的电极反应方程式为:________________________________________________。Y极每生成标况下22.4LCl2,有_________molLi+经过离子导体。
【答案】温度升高可加快浸出速率 2FePO4+Li2CO3+H2C2O4.2H2O![]() 2LiFePO4+3CO2↑+3H2O↑ C Li2CO3在冷水中的溶解度比热水中大,热水洗涤可减少Li2CO3的溶解度损耗,提高产率 负极 2H++2e-=H2↑ 2
2LiFePO4+3CO2↑+3H2O↑ C Li2CO3在冷水中的溶解度比热水中大,热水洗涤可减少Li2CO3的溶解度损耗,提高产率 负极 2H++2e-=H2↑ 2
【解析】
根据题意、流程进行分析。锂辉石的主要成分为LiAl(SiO3)2,还含微量的钠、钙、镁等元素,加入硫酸酸浸后过滤,所得滤液中主要含Li2SO4、A12(SO4)3,还含有硫酸、Na+、Mg2+等;加入石灰水将滤液中的硫酸中和、A13+和Mg2+转化为沉淀而除去;过滤后加入饱和碳酸钠溶液使Li+转化成Li2CO3 ,沉淀,据此分析作答。
(1)根据升高温度,增大反应速率,则在“硫酸浸出“流程中,将硫酸加热到130℃是为了加快浸出速率;答案为提高浸出速率。
(2)制取电池材料磷酸亚铁锂(LiFePO4)时,反应物有FePO4、Li2CO3和草酸晶体(H2C2O4·2H2O),生成物为LiFePO4,铁元素的化合价降低,则该过程中某种物质被氧化,根据元素化合价变化规律,可知草酸中的C元素被氧化,由+3价升高为+4价,结合电子守恒和元素守恒可知,产物中还含有CO2和H2O,所以化学方程式为2FePO4+Li2CO3+ H2C2O4·2H2O![]() 2LiFePO4+3CO2↑+3H2O↑;答案为2FePO4+Li2CO3+ H2C2O4·2H2O
2LiFePO4+3CO2↑+3H2O↑;答案为2FePO4+Li2CO3+ H2C2O4·2H2O![]() 2LiFePO4+3CO2↑+3H2O↑。
2LiFePO4+3CO2↑+3H2O↑。
(3)锂元素的焰色反应为紫红色;铁元素无焰色反应;答案为C。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4



