题目内容
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。下列说法正确的是

A.反应①是氧化还原反应,反应②是非氧化还原反应
B.Fe+使反应的活化能减小,FeO+是中间产物
C.两步反应均为放热反应,总反应的化学反应速率由反应②决定
D.若转移lmol电子,则消耗1molN2O
【答案】B
【解析】
A.反应②中碳元素的化合价由+2价变为+4价 ,铁元素的化合价由+3价变为+1价,有元素化合价的升降,因此是氧化还原反应,反应①也是氧化还原反应,故A错误;
B.Fe+作催化剂,使反应的活化能减小,FeO+是反应过程中产生的物质,因此是中间产物,故B正确;
C.由图可知,Fe++N2O=FeO++N2、FeO++CO=Fe++CO2两步中均为反应物总能量大于生成物总能量,所以两个反应都是放热反应,总反应的化学反应速率由速率慢的反应①决定,故C错误;
D.根据反应①N2O+Fe+=N2+FeO+可知,氮元素由N2O→N2,化合价由+1价变为0价,消耗1molN2O,生成1molN2,转移2mol电子,故D错误;
答案为B。

【题目】在20 L的密闭容器中按物质的量之比为1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
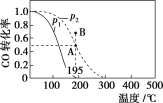
p2及195 ℃ 时n(H2)随时间变化
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A. p1>p2,ΔH<0
B. 在p2及195 ℃ 时,反应前3 min的平均速率v(CH3OH)=0.8 mol·L-1·min-1
C. 在p2及195 ℃ 时,该反应的平衡常数为25
D. 在B 点时,v正>v逆
【题目】N2O俗名为“笑气”,也是一种温室气体。结合所学知识,回答下列问题:
(1)锌与极稀硝酸反应可生成N2O,该反应的化学方程式为___________,其中作氧化剂的硝酸与参与反应的硝酸的物质的量之比为___________。
(2)已知几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | N2(g) | CO2(g) |
相对能量/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
①N2O(g)和CO(g)反应生成N2(g)和CO2(g)的热化学方程式为____________。
②若其他条件不变,加入高效催化剂,该反应的焓变将_______(填“增大”、“减小”或“不变”)。
(3)碘蒸气能催化N2O的分解,反应历程(步骤)如下:
i.I2(g)2I(g)
ii.I(g)+N2O(g)=N2(g)+IO(g)
iii.2IO(g)+2N2O(g)=2N2(g)+2O2(g)+I2(g)
实验表明,在反应过程c(I)始终大于c(IO),由此推测,反应速率ii_________iii(填“>”、“<”或“=”)。
(4)一定温度下,向恒容密闭容器中充入2 mol N2O(g)和3 mol NO(g),发生反应:N2O(g)+NO(g)N2(g)+NO2(g) △H。测得N2体积分数与温度、时间的关系如图所示。
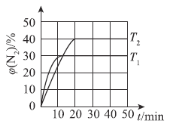
①△H___________0(填“>”、“<”或“=”)。
②下列情况表明该反应达到平衡状态的是___________(填字母)。
A.混合气体的密度不再改变 B.相对分子质量不再改变
C.NO和NO2的消耗速率相等 D.N2O的体积分数不再改变
③T1时,该反应的平衡常数K=___________。