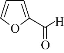
题目内容
【题目】已知浓硫酸的密度是1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%。取10mL浓硫酸和a mL水混合得到溶液的物质的量浓度为c mol/L,质量分数为b%。下列组合正确的是( )
(1)若c=9.2,则a<18.4,b>49 (2)若c=9.2,则a<18.4,b<49
(3)若b=49,则a=18.4,c<9.2 (4)若b=49,则a=18.4,c>9.2。
A.(1)(3)B.(1)(4)C.(2)(3)D.(2)(4)
【答案】A
【解析】
若b=49,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%=(10mL×1.84g/mL+a mL×1g/mL)×49%,解得a=18.4;令稀释后的密度为d g/mL,则d<1.84,稀硫酸的物质的量浓度c=![]() <9.2mol/L;
<9.2mol/L;
若c=9.2,令稀释后的密度为d g/mL,则d<1.84,稀释过程中溶质硫酸的物质的量不变,10mL×18.4mol/L=![]() ,所以a<18.4mL;
,所以a<18.4mL;
若c=9.2,则溶液体积变为20mL,令稀释后的密度为d g/mL,则d<1.84,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%=20mL×d g/mL×b%,则b>49;
故选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目