题目内容
【题目】已知某“84消毒液”瓶体部分标签如图所示,已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比) 后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_____mol·L-1。
(2)取用任意体积的该盐溶液时,下列物理量中会随所取体积的多少而变化的是______(填字母)。
A.溶液中NaClO的物质的量 B.溶液的浓度 C.溶液中NaClO的摩尔质量 D.溶液的密度
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
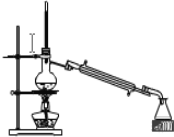
①如图所示的仪器中,有些是不需要,配制上述溶液还需要_____________玻璃仪器

②需要称量NaClO固体的质量为_______ g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制230mL 2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
【答案】4.0 A 玻璃棒、胶头滴管 149.0 4.6 31.25 D
【解析】
(1)根据![]() 计算该“84消毒液”的物质的量浓度;
计算该“84消毒液”的物质的量浓度;
(2)根据该物理量是否与溶液的体积有关判断;
(3)①根据配制溶液的步骤判断需要的仪器;
②配制480mL含NaClO质量分数为25%的溶液,需要用500mL容量瓶,利用500mL计算所需次氯酸钠的质量;
(4)硫酸是强电解质,氢离子浓度是硫酸浓度的2倍;
②根据稀释前后硫酸的质量不变计算浓硫酸的体积,需用250 mL容量瓶配制该稀硫酸;
③根据![]() 判断误差。
判断误差。
(1)该“84消毒液”的物质的量浓度![]() 4.0mol·L-1;
4.0mol·L-1;
(2)A.溶液中NaClO的物质的量=cV,所以与溶液的体积有关,A正确;
B.溶液的浓度![]() ,与溶液的体积无关,B错误;
,与溶液的体积无关,B错误;
C.NaClO的摩尔质量的数值等于相对分子质量,所以与溶液的体积无关,C错误;
D.溶液的密度与溶液的体积无关,D错误;
故选A;
(3)①配制该溶液需要用托盘天平称取次氯酸钠,在烧杯中溶解,然后转移到500 mL容量瓶中,并用胶头滴管定容,需要的仪器是托盘天平、烧杯、玻璃棒、500 mL容量瓶、胶头滴管,缺少的仪器是玻璃棒、胶头滴管;
②配制480mL含NaClO质量分数为25%的溶液,需要用500 mL容量瓶,m(NaClO)= 4.0mol·L-1×0.5L×74.5g/mol=149.0g;
(4)①硫酸是强电解质,氢离子浓度是硫酸浓度的2倍,所以2.3 mol·L-1的稀硫酸中,H+的物质的量浓度为4.6mol·L-1;
②需用250mL容量瓶配制该稀硫酸,设需要浓硫酸的体积是V mL,250 mL× 2.3 mol·L-1×98g/mol=V mL×1.84g·cm-3×98%,解得V=31.25mL;
③A.配制前,容量瓶中有少量蒸馏水,所配制的稀硫酸浓度无影响,A错误;
B.量取浓硫酸时,仰视液体的凹液面,浓硫酸体积偏大,所配制的稀硫酸浓度偏大,故B错误;
C.未冷却,立即转移至容量瓶定容,所配溶液体积偏小,所配制的稀硫酸浓度偏大,故C错误;
D.定容时,仰视溶液的凹液面,所配溶液体积偏大,所配制的稀硫酸浓度偏小,D正确;
故选D。