题目内容
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是
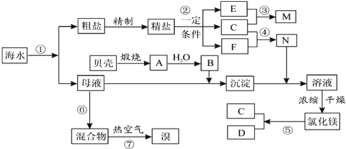
A.富集溴元素过程中,热空气吹出法利用了溴易挥发的性质
B.因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C.反应⑥所用的气态氧化剂可从本厂生产烧碱处理循环利用或从本厂生产镁单质处理循环利用
D.MgCl2·6H2O必须在氯化氢氛围条件下加热制得无水氯化镁
【答案】B
【解析】
A. 溴单质具有挥发性,富集溴元素过程中,热空气吹出法利用了溴易挥发的性质,故A正确;
B.氮气在高温下可与镁蒸气反应生成二氮化三镁,故B错误;
C. 反应⑥所用的气态氧化剂为氯气,可从本厂电解饱和食盐水生产烧碱时产生的氯气循环利用或从本厂电解氯化镁溶液生产镁单质时产生的氯气循环利用,故C正确;
D. MgCl2属于强酸弱碱盐,镁离子加热条件下会发生水解生成氢氧化镁,则MgCl2·6H2O必须在氯化氢氛围条件下加热制得无水氯化镁,以防止氯化镁水解,故D正确;
答案选B。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】下表给出了14种元素的电负性:
元素 | 电负性 | 元素 | 电负性 | 元素 | 电负性 |
Al | 1.5 | B | 2.0 | Be | 1.5 |
C | 2.5 | Cl | 3.0 | F | 4.0 |
Li | 1.0 | Mg | 1.2 | N | 3.0 |
Na | 0.9 | O | 3.5 | P | 2.1 |
Cl | 2.5 | S | 1.8 |
(1)同一周期中,从左到右,主族元素的电负性_________;同一主族中,从上到下,元素的电负性_________。主族元素的电负性随原子序数递增呈_________变化。
(2)短周期元素中,电负性最大的元素与电负性最小的元素形成的化合物属于____________化合物,用电子式表示该化合物:___________________。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键,则Mg3N2、BeCl2、AlCl3、SiC中为离子化合物的是_________,为共价化合物的是__________________________。