题目内容
19.下列条件下,两瓶气体所含的原子数一定相等的是( )①同质量不同密度的CO和N2
②同温同体积的H2和Cl2
③同体积同密度的O2和O3
④同压同体积的N2O和CO2.
| A. | ①③ | B. | ①② | C. | ②④ | D. | ③④ |
分析 ①CO和N2 的摩尔质量相等,二者质量相等,则物质的量相等,均为双原子分子,含有原子数目相等;
②同温度、同体积,气体分子数目与压强呈正比;
③同体积同密度的O2和O3的质量相等,均由氧原子构成,则含有氧原子数目相等;
④同压、同体积的N2O和CO2,温度影响气体分子数目.
解答 解:①CO和N2 的摩尔质量相等,二者质量相等,根据n=$\frac{m}{M}$可知二者物质的量相等,均为双原子分子,含有原子数目相等,故①正确;
②同温度、同体积,气体分子数目与压强呈正比,压强不定,无法判断气体分子数关系,含有原子数目不一定相等,故②错误;
③同体积同密度的O2和O3的质量相等,均由氧原子构成,氧原子质量相等,则含有氧原子数目相等,故③正确;
④同压、同体积的N2O和CO2,温度影响气体分子数目,温度不确定,则无法判断气体分子数关系,含有原子数目不一定相等,故④错误,
故选:A.
点评 本题考查阿伏伽德罗定律及推论,难度不大,注意公式的灵活运用,可借助pV=nRT理解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列物质既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的是( )
| A. | 乙酸乙酯 | B. | 甲烷 | C. | 乙酸 | D. | 植物油 |
10.某无色溶液中加入过量的稀盐酸有沉淀生成,过滤后向碱溶液中加入过量的纯碱溶液又有沉淀生成,下列溶液中符合此条件的是( )
①Ag+、Fe3+、Na+
②Ag+、Al3+、K+
③Ag+、Ba2+、NO${\;}_{3}^{-}$
④SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{2-}$、K+
⑤Ag+、NH${\;}_{4}^{+}$、H+
⑥AlO2-、K+、Al3+.
①Ag+、Fe3+、Na+
②Ag+、Al3+、K+
③Ag+、Ba2+、NO${\;}_{3}^{-}$
④SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{2-}$、K+
⑤Ag+、NH${\;}_{4}^{+}$、H+
⑥AlO2-、K+、Al3+.
| A. | ①②⑤ | B. | ②③④ | C. | ②③④⑥ | D. | ①②③④⑥ |
14.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,22.4L氧气所含的原子数为2NA | |
| B. | 17g的OH-离子中含有的电子数为9NA | |
| C. | 常温常压下,44gCO2含有的氧原子数为2NA | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
4.下列电离方程式中,书写正确的是( )
| A. | Cu(OH)2=Cu2++2 OH- | B. | NH3•H2O?NH4++OH- | ||
| C. | HF=H++F- | D. | H3PO43?3H++PO43- |
11.pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,停止电解,取出电极,将溶液摇匀,测得溶液的pH>a,则该电解质溶液是( )
| A. | K2SO4 | B. | NaOH | C. | NaCl | D. | AgNO3 |
8.为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
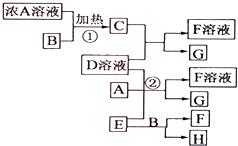 以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H. ;
;