题目内容
14.铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:(1)生铁中含有一种铁碳化合物X(Fe3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是Fe2+、Fe3+、H+.
(2)某溶液中有Mg2+、Fe2+、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是BC.
A.Mg2+B.Fe2+C.A13+D.Cu2+
(3)氧化铁是重要工业颜料,用废秩屑制备它的流程如图:
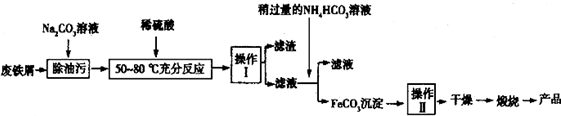
回答下列问题:
①操作Ⅰ的名称是过滤,操作Ⅱ的名称是洗涤;
②请完成生成FeCO3沉淀的离子方程式Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250mL容量瓶.
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是C.
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸.
分析 (1)FeC在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,与过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+;
(3)①由工艺流程可知,操作I是将固体与液体分离,应采取过量的方法;FeCO3沉淀会附着其它离子,需要进行洗涤,减少杂质;
②由工艺流程可知,操作I所得的滤液中主要有硫酸亚铁,加入碳酸氢铵,实质是亚铁离子与碳酸氢根离子反应,生成FeCO3,同时生成二氧化碳、水;
(4)①根据配制一定物质的量浓度的溶液所需要的仪器来回答;
②高锰酸钾具有强氧化性,能氧化盐酸,硝酸本身有强氧化性,被还原后生成氮的氧化物.
解答 解:(1)FeC在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,溶于过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl,溶液中大量存在的阳离子是Fe2+、Fe3+、H+,
故答案为:Fe2+、Fe3+、H+;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+,故选BC,
故答案为:BC;
(3)①由工艺流程可知,操作I是将固体与液体分离,应采取过量的方法;FeCO3沉淀会附着其它离子,需要进行洗涤,减少杂质,所以操作Ⅱ为洗涤,
故答案为:过滤;洗涤;
②由工艺流程可知,操作I所得的滤液中主要有硫酸亚铁,加入碳酸氢铵,实质是亚铁离子与碳酸氢根离子反应,生成FeCO3,同时生成二氧化碳、水,反应离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(4)①根据配制一定物质的量浓度的溶液所需要的仪器有:250mL容量瓶、天平、玻棒、烧杯、量筒、药匙、胶头滴管,故答案为:250mL容量瓶;
②高锰酸钾具有强氧化性,能氧化盐酸,硝酸本身有强氧化性,被还原后生成氮的氧化物,所以不能用盐酸、硝酸酸化高锰酸钾,故选C.
点评 本题考查元素化合物性质、化学工艺流程、基本操作与方案设计、盐类水解、常用化学用语等,难度中等,是对所学知识的综合利用,(3)②中离子方程式的书写,为易错点,根据配平判断有二氧化碳生成.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| A. | 在Fe+Cu2+=Fe2++Cu的反应中Fe作还原剂,在Fe于其他物质反应中Fe一定也作还原剂 | |
| B. | 在上述反应中,氧化性:Fe2+>Cu2+ | |
| C. | 金属活动性顺序表中,排在前面的金属阳离子氧化性强于排在后面的金属阳离子 | |
| D. | SO42-中的硫原子化合价是+6价,处于硫的最高价,因此SO42-氧化性一定很强 |
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 乙二醇 | -11.5℃ | 198℃ | 1.11g•cm-3 | 易溶于水和乙醇 |
| 丙三醇 | 17.9℃ | 290℃ | 1.26g•cm-3 | 跟水、酒精任意比互溶 |
| A. | 萃取法 | B. | 结晶法 | C. | 分液法 | D. | 蒸馏法 |