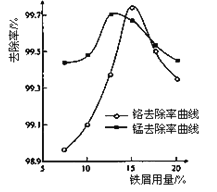
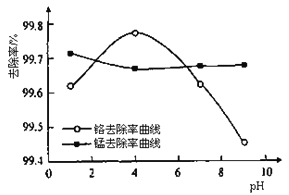
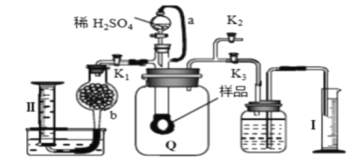
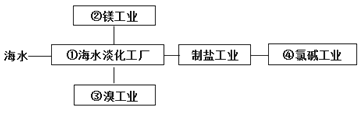
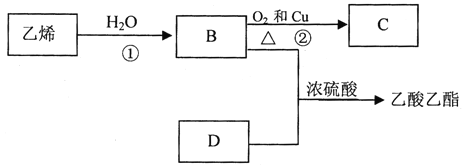
题目内容
【题目】(1)写出N2的结构式:________。
(2)写出1,2-二溴乙烷的结构简式:_________。
(3)写出乙烯与水发生加成反应的化学方程式: _____________。
(4)已知0.2mol液态肼(N2H4)与足量的液态双氧水反应,生成氮气和水蒸气,放出128 kJ的热量。此反应的热化学方程式:____。
【答案】![]() CH2BrCH2Br CH2=CH2+H2O
CH2BrCH2Br CH2=CH2+H2O ![]() CH3CH2OH N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) ΔH=-640 kJ/mol
CH3CH2OH N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) ΔH=-640 kJ/mol
【解析】
(1)N2是共用三对电子。
(2)1,2-二溴乙烷,有两个碳,两个溴,每个溴连在一个碳原子上。
(3)乙烯与水发生加成反应生成乙醇。
(4)已知0.2mol液态肼(N2H4)与足量的液态双氧水反应,生成氮气和水蒸气,放出128kJ的热量,则1mol液态肼(N2H4)反应放出640 kJ的热。
(1)N2是共用三对电子,因此N2的结构式:![]() ;故答案为:
;故答案为:![]() 。
。
(2)1,2-二溴乙烷,有两个碳,两个溴,每个溴连在一个碳原子上,再根据碳原子4个价键填氢原子个数,因此其结构简式:CH2BrCH2Br;故答案为:CH2BrCH2Br。
(3)乙烯与水发生加成反应生成乙醇,其化学方程式: CH2=CH2+H2O ![]() CH3CH2OH;故答案为:CH2=CH2+H2O
CH3CH2OH;故答案为:CH2=CH2+H2O ![]() CH3CH2OH。
CH3CH2OH。
(4)已知0.2mol液态肼(N2H4)与足量的液态双氧水反应,生成氮气和水蒸气,放出128kJ的热量,则1mol 液态肼(N2H4)反应放出640 kJ的热,此反应的热化学方程式:N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) ΔH=-640 kJ·mol1;故答案为:N2H4(l)+2H2O2(l) = N2(g)+4H2O(g) ΔH=-640 kJ·mol1。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案