题目内容
5.制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤.完成下列计算:(1)CaCO3质量分数为0.90的石灰石100kg完成分解产生CO220160L(标准状况下).
(2)石灰窑中,该石灰石100kg与焦炭混合焙烧,产生CO2 29120L(标准状况下),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为400mol.
(3)已知粗盐水含MgCl2 6.80mol/m3,含CaCl2 3.00mol/m3.向粗盐水中加入Ca(OH)2除镁离子:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,然后加入Na2CO3除钙离子.处理上述粗盐水10m3,至少需要加Na2CO310388g.
(4)如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2++2NH3+CO2+H2O═CaCO3↓+2NH4+.处理上述10m3粗盐水至少需要通入54880L(标准状况下)碳酸化尾气.
分析 (1)n(CaCO3)=$\frac{1×1{0}^{5}g×0.90}{100g/mol}$=900mol,根据C原子守恒得n(CO2)=n(CaCO3)=900mol,根据V=nVm计算二氧化碳体积;
(2)n(CaCO3)=$\frac{1×1{0}^{5}g×0.90}{100g/mol}$=900mol,根据C原子守恒得碳酸钙生成n(CO2)=n(CaCO3)=900mol,产生的总n(CO2)=$\frac{29120L}{22.4L/mol}$=1300mol,则C生成的二氧化碳物质的量为1300mol-900mol=400mol,根据C原子守恒计算焦炭物质的量;
(3)粗盐水10m3,则该粗盐水中n(MgCl2 )=6.80mol/m3×10m3=68mol,n(CaCl2)=3.00mol/m3×10m3=30mol,根据MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2知氯化镁生成氯化钙物质的量为n(MgCl2 )=n(CaCl2)=68mol,则总的n(CaCl2)=68mol+30mol=98mol,氯化钙和碳酸钠反应时以1:1反应,则需要碳酸钠物质的量为98mol,根据m=nM计算碳酸钠质量;
(4)反应中NH3、CO2按物质的量之比2:1反应,而碳酸化尾气中NH3、CO2的物质的量之比为0.1:0.04=2.5:1,故反应中氨气有剩余,根据钙离子物质的量计算二氧化碳的物质的量,结合二氧化碳的体积分数计算碳酸化尾气的体积.
解答 解:(1)n(CaCO3)=$\frac{1×1{0}^{5}g×0.90}{100g/mol}$=900mol,根据C原子守恒得n(CO2)=n(CaCO3)=900mol,V(CO2)=nVm=900mol×22.4L/mol=20160L,
故答案为:20160;
(2)n(CaCO3)=$\frac{1×1{0}^{5}g×0.90}{100g/mol}$=900mol,根据C原子守恒得碳酸钙生成n(CO2)=n(CaCO3)=900mol,产生的总n(CO2)=$\frac{29120L}{22.4L/mol}$=1300mol,则C生成的二氧化碳物质的量为1300mol-900mol=400mol,根据C原子守恒得n(C)=n(CO2)=400mol,故答案为:400;
(3)粗盐水10m3,则该粗盐水中n(MgCl2 )=6.80mol/m3×10m3=68mol,n(CaCl2)=3.00mol/m3×10m3=30mol,根据MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2知氯化镁生成氯化钙物质的量为n(MgCl2 )=n(CaCl2)=68mol,则总的n(CaCl2)=68mol+30mol=98mol,氯化钙和碳酸钠反应时以1:1反应,则需要碳酸钠物质的量为98mol,m(Na2CO3)=nM=98mol×106g/mol=10388g,故答案为:10388;
(4)加入的碳酸钠除钙离子,溶液中n(Ca2+)=n(Na2CO3)=98mol,反应中NH3、CO2按物质的量之比2:1反应,而碳酸化尾气中NH3、CO2的物质的量之比为0.1:0.04=2.5:1,故反应中氨气有剩余,根据Ca2++2NH3+CO2+H2O→CaCO3↓+2NH4+,可知需要二氧化碳为98mol,故需要碳酸化尾气的体积为98mol×22.4L/mol÷0.04=54880L,
故答案为:54880.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量之间关系是解本题关键,注意原子守恒的灵活运用,题目难度不大.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案| A. | 10% | B. | 20% | C. | 30% | D. | 40% |
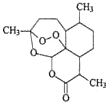 中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
中国科学家屠呦呦因创制了具有国际影响的新型抗疟药--青蒿素和双氢青蒿素,获得2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 分子中含有3种官能团 | |
| B. | 易溶于苯,难溶于水 | |
| C. | 可与NaOH溶液发生水解反应 | |
| D. | 其同分异构体不可能有芳香族化合物 |
| A. | 5.6克铁反应转移的电子数一定为3NA | |
| B. | 1mol Cl2反应转移的电子数一定是2NA | |
| C. | 标准状况下,22.4L SO3含有的氧原子数目为3NA | |
| D. | 1mol碳正离子CH5+所含的电子总数为10NA |
| A. | 0.2mol•L-1Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL2mol•L-1NaCl溶液和100mL0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢所得盐酸的浓度是1mol•L-1 | |
| D. | 10g98%的硫酸(密度为1.84g•cm-3)与10mL18.4mol•L-1的硫酸的浓度是相同的 |
| A. | Na2CO3溶液 | B. | 溴水 | C. | 新制氢氧化铜 | D. | 福尔马林 |
| A. | 吸水性 | B. | 强酸性 | C. | 脱水性 | D. | 强氧化性 |
| A. | 胶体通直流电胶粒向两极移动,非电解质溶液通直流电溶质不移动 | |
| B. | 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 | |
| C. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明显光带 | |
| D. | 溶液稳定,放置后不会生成沉淀;胶体不稳定,放置会生成沉淀 |
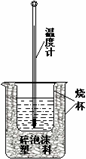 用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: