题目内容
7.已知短周期元素形成的离子aA+、bB2+、cC-、dD2-均具有相同的电子层结构,下列判断正确的是( )| A. | 元素的金属性:B>A;元素的非金属性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 离子半径:D2->C->B2+>A+ | |
| D. | 原子半径:A>B>C>D |
分析 aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,可知原子序数:b>a>c>d,由离子所带电荷可知,C、D为非金属,应处于第二周期,故C为F元素,D为O元素,A、B为金属,应处于第三周期,A为Na元素,B为Mg元素,结合元素周期律解答.
解答 解:aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,可知原子序数:b>a>c>d,由离子所带电荷可知,C、D为非金属,应处于第二周期,故C为F元素,D为O元素,A、B为金属,应处于第三周期,A为Na元素,B为Mg元素.
A.同周期随原子序数增大,金属性减弱、非金属性增强,故元素的金属性:Mg<Na,元素的非金属性:O>F,故A错误;
B.四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,可知原子序数:b>a>c>d,故B正确;
C.原子序数:b>a>c>d,电子层结构相同,核电荷数越大离子半径越小,则离子半径:D2->C->A+>B2+,故C错误;
D.同周期元素从左到右原子半径逐渐减小,、同主族自上而下原子半径增大,故则原子半径大小为:A>B>D>C,故D错误,
故选B.
点评 本题考查结构与位置关系、元素周期律等,难度中等,注意元素周期律的理解掌握,也可以根据电荷与核外电子排布相同推断元素在周期表中的位置而不需要推断具体的元素.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
10.下列物质中,不属于醇类的是( )
| A. | C4H9OH | B. | C6H5CH2OH | C. | C6H5OH | D. | 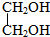 |
18.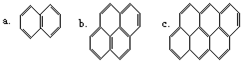 在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )
在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )
 在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )
在沥青的蒸气中含有稠环芳香烃,其中一些成分可视为“同系物”,如:以此顺序推测还可以有d、e、f…等,在该系列化合物中,碳的最大百分含量是( )| A. | 100% | B. | 56% | C. | 97.3% | D. | 93.8% |
2.下列关于元素周期律和元素周期表的说法中正确的是( )
| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 目前已知发现的第ⅥA族元素为5种,所以该族元素共有5种单质 |
12.下列说法正确的是( )
| A. | 在水中能电离出离子的化合物一定是离子化合物 | |
| B. | CO2分子中含极性键,且溶于水能导电,所以CO2是电解质 | |
| C. | Ca(OH)2微溶于水,所以是弱电解质 | |
| D. | CH3COOH在水中只能部分电离,所以是弱电解质 |
19.常温下,向10mL0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NH3•H2O溶液,其pH逐渐增大,图中a、b、c三点的pH为实验所测得.下列有关说法中一定错误的是( )
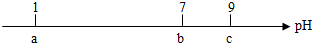
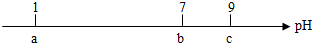
| A. | 常温下,0.1mol•L-1的HCl溶液的pH=1 | |
| B. | 当pH=7时,所加NH3•H2O溶液的体积大于10mL | |
| C. | 当7<pH<9时,溶液中c(NH4+)>c(Cl-) | |
| D. | 继续滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最终可以变化至13 |
16.下列叙述错误的是( )
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | 1H和2H是不同的核素,它们的质子数相同 | |
| C. | 14C和14N的质量数相同,它们的中子数不等 | |
| D. | 6Li和7Li电子数相同,中子数也相同 |
17.人们在远距离运输果实或花朵时,装有果实或花朵的密闭容器中,常常放有浸泡过KMnO4(aq)的硅土,其作用是( )
| A. | 给容器消毒 | B. | 杀死果实周围的细菌,防止霉变 | ||
| C. | 延长果实或花朵的寿命 | D. | 催熟果实或花朵 |